Rivaroxabana
NARATRIPTANA
Cloridrato de Naratriptana, para o que é indicado e para o que serve?
Cloridrato de Naratriptana é indicado para o tratamento agudo de crises de enxaqueca, com ou sem aura.
Quais as contraindicações do Cloridrato de Naratriptana?
Cloridrato de Naratriptana é contraindicado em indivíduos com conhecida hipersensibilidade o Cloridrato de Naratriptana ou a qualquer componente da fórmula.
Cloridrato de Naratriptana não deve ser usado por pacientes com antecedentes de infarto agudo do miocárdio ou cardiopatia isquêmica, angina de Prinzmetal/vasoespasmo coronariano, doença vascular periférica ou por pacientes com sintomas ou sinais compatíveis com cardiopatia isquêmica.
Cloridrato de Naratriptana não deve ser administrado em pacientes com histórico de acidente vascular cerebral ou ataque isquêmico transitório.
Cloridrato de Naratriptana é contraindicado para pacientes com hipertensão grave não controlada e para pacientes com grave insuficiência hepática ou renal.
Este medicamento é contraindicado para uso por pacientes com antecedentes de infarto agudo do miocárdio ou cardiopatia isquêmica, angina de Prinzmetal/vasoespasmo coronariano, doença vascular periférica ou por pacientes com sintomas ou sinais compatíveis com cardiopatia isquêmica.
Este medicamento é contraindicado para uso por pacientes com histórico de acidente vascular cerebral ou ataque isquêmico transitório.
Este medicamento é contraindicado para uso por pacientes com insuficiência renal grave.
Este medicamento é contraindicado para uso por pacientes com insuficiência hepática grave.
Este medicamento é contraindicado para uso por pacientes com hipertensão grave não controlada.
Como usar o Cloridrato de Naratriptana?
Uso oral.
Cloridrato de Naratriptana deve ser administrado, preferencialmente, tão logo se inicie uma crise de enxaqueca, mas também é eficaz quando tomado algum tempo após a instalação da crise.
Cloridrato de Naratriptana não deve ser usado profilaticamente.
Os comprimidos devem ser ingeridos inteiros e com água.
Posologia do Cloridrato de Naratriptana
Adultos
A dose recomendada para adultos é de um comprimido de 2,5 mg. A dose total não deve ultrapassar dois comprimidos de 2,5 mg em um período de 24 horas.
Se os sintomas da enxaqueca recidivarem, após uma resposta inicial, uma segunda dose pode ser tomada desde que haja um intervalo mínimo de 4 horas entre as duas doses. Se um paciente não responder à primeira dose, é pouco provável que uma segunda dose apresente benefício substancial, na mesma crise.
Cloridrato de Naratriptana pode ser administrado nas próximas crises de enxaqueca, considerando que a dose máxima não deve ultrapassar dois comprimidos de 2,5mg em 24 horas..
Adolescentes (12 a 17 anos)
A eficácia da naratriptana nessa faixa de idade ainda não foi demonstrada e, portanto, seu uso não é recomendado. Em um estudo clínico em adolescentes, foi observada uma resposta muito alta ao placebo.
Crianças (com menos de 12 anos)
Ainda não há dados disponíveis a respeito do uso da naratriptana em crianças com menos de 12 anos de idade. Portanto, seu uso nesse grupo de pacientes não é recomendado.
Idosos (com mais de 65 anos)
A segurança e a eficácia da naratriptana em indivíduos com mais de 65 anos de idade ainda não foram avaliadas. Portanto, seu uso não é recomendado. Há um decréscimo no clearance com a idade.
Pacientes com insuficiência renal
A dose diária máxima em pacientes com insuficiência renal é de um único comprimido de 2,5 mg. O uso da naratriptana é contraindicado para pacientes com insuficiência renal grave (clearance de creatinina < 15mL/min).
Pacientes com insuficiência hepática
A dose máxima diária em pacientes com insuficiência hepática é de um único comprimido de 2,5 mg. O uso da naratriptana é contraindicado para pacientes com insuficiência hepática grave (Child-Pugh grau C).
Este medicamento não deve ser partido ou mastigado.
Quais as reações adversas e os efeitos colaterais do Cloridrato de Naratriptana?
As frequências dos eventos muito comuns, comuns e incomuns foram determinadas a partir de estudos clínicos. A identificação de reações adversas muito raras deriva de dados do sistema de farmacovigilância pós-comercialização.
Dados de estudos clínicos
Em doses terapêuticas de Cloridrato de Naratriptana, a incidência de efeitos colaterais reportada em estudos clínicos foi similar à do placebo.
Reações comuns (≥1/100 e <1/10)
- Parestesia(dormência). Esse sintoma é normalmente de curta duração, mas pode ser grave e afetar qualquer parte do corpo, incluindo o tórax e a garganta;
- Náuseas e vômitos. Esses sintomas ocorreram em alguns pacientes, mas a relação com a naratriptana não está estabelecida;
- Dor e sensação de calor. Esses sintomas são normalmente de curta duração, mas podem ser graves e afetar qualquer parte do corpo, incluindo o tórax e a garganta.
Reação incomum (≥1/1.000 e <1/100)
- Sensações de peso, pressão ou aperto. Esses sintomas são normalmente de curta duração, mas podem ser graves e afetar qualquer parte do corpo, incluindo o tórax e a garganta.
Dados de farmacovigilância pós-comercialização
Reação rara (≥1/10.000 e <1000)
- Sonolência.
Reações muito raras (<1/10.000)
- Reações de hipersensibilidade, variando de hipersensibilidade cutânea a anafilaxia; vasoespasmo arterial coronariano, alterações eletrocardiográficas isquêmicas transitórias, angina e infarto do miocárdio;
- Isquemia vascular periférica;
- Coliteisquêmica.
Em caso de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
Superdose: o que acontece se tomar uma dose do Cloridrato de Naratriptana maior do que a recomendada?
A administração de uma dose elevada (25 mg) de naratriptana em um paciente saudável do sexo masculino elevou a pressão sanguínea em 71 mmHg, resultando em sensação de cabeça vazia, tensão no pescoço, cansaço e perda da coordenação. A pressão sanguínea retornou à linha basal oito horas após a dosagem, sem outra intervenção farmacológica.
Tratamento
Se ocorrer superdosagem com naratriptana, o paciente deve ser monitorado por pelo menos 24 horas e devem ser aplicadas as medidas de suporte habituais. Ainda não se conhece o efeito da hemodiálise ou da diálise peritoneal sobre a concentração plasmática da naratriptana.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
Interação medicamentosa: quais os efeitos de tomar Cloridrato de Naratriptana com outros remédios?
Síndrome serotoninérgica (incluindo estado mental alterado, instabilidade autonômica e anormalidades neuromusculares) tem sido relatada devido ao tratamento concomitante de triptanos com ISRS/IRSN.
Não há evidências de interação farmacocinética entre naratriptana e betabloqueadores, antidepressivos tricíclicos, ISRS, álcool ou alimentos. A naratriptana não inibe a enzima monoaminoxidase, portanto não são previstas interações com os inibidores dessa enzima. Além disso, o metabolismo limitado da naratriptana e a ampla gama de isoenzimas do citocromo P450 envolvidas sugerem que são pouco prováveis interações medicamentosas significativas.
Quais cuidados devo ter ao usar o Cloridrato de Naratriptana?
Cloridrato de Naratriptana deve ser usado somente quando há diagnóstico claro de enxaqueca.
O produto não é indicado para o controle da enxaqueca hemiplégica, basilar ou oftalmoplégica.
Assim como com outras terapias agudas para enxaqueca, antes de tratar pacientes sem diagnóstico prévio de enxaqueca ou pacientes com enxaqueca com sintomas atípicos, deve-se excluir outras condições neurológicas potencialmente graves. Esses pacientes podem estar em risco de eventos cerebrovasculares (por exemplo, acidente vascular cerebral ou ataque isquêmico transitório).
Assim como se aplica a outros agonistas dos receptores da 5-hidroxitriptamina (5-HT1), a naratriptana não deve ser administrada em pacientes pertencentes ao grupo de risco de doenças cardíacas sem avaliação prévia de doença cardiovascular subjacente. Esse grupo inclui mulheres após a menopausa, homens acima de 40 anos de idade e pacientes com fatores de risco para doenças coronarianas. Se ocorrerem sintomas sugestivos de cardiopatia isquêmica, deve ser feita a avaliação adequada.
Síndrome serotoninérgica (incluindo estado mental alterado, instabilidade autonômica e anormalidades neuromusculares) tem sido relatada devido ao uso concomitante de triptanos com inibidores seletivos de recaptação da serotonina (ISRS) / inibidores de recaptação da serotonina e da noradrenalina (IRSN). Se o tratamento com naratriptana e um ISRS/ISRN for necessário, é recomendada a observação apropriada do paciente.
A administração concomitante de ergotamina, derivados da ergotamina (inclusive metisergida) ou qualquer triptano/agonista 5-HT1 com Cloridrato de Naratriptana não é recomendada. Entretanto, a coadministração de naratriptana com ergotamina, diidroergotamina ou sumatriptana não resultou em efeitos clinicamente significativos na pressão arterial, na frequência cardíaca ou no ECG e não afetou a farmacocinética da naratriptana.
A naratriptana possui um grupamento sulfonamídico na molécula. Portanto, teoricamente, existe risco de reações de hipersensibilidade em pacientes com conhecida hipersensibilidade às sulfonamidas.
Deve-se evitar exceder a dose máxima recomendada de naratriptana. O uso excessivo de tratamentos para enxaqueca aguda foi associado à exacerbação da dor de cabeça em pacientes suscetíveis. A interrupção do tratamento pode ser necessária.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
O paciente deve ter cuidado ao dirigir ou operar máquinas, pois pode ocorrer sonolência como consequência da enxaqueca ou do tratamento com Cloridrato de Naratriptana.
Teratogenicidade
A avaliação de estudos experimentais em animais não indicou nenhum efeito teratogênico direto ou nocivo sobre o desenvolvimento peri ou pós-natal.
Gravidez
Estudos em animais não indicam toxicidade reprodutiva (ver Teratogenicidade, acima).
Dados pós-comercialização obtidos de registros prospectivos de gestações documentam os resultados da exposição de mulheres a Cloridrato de Naratriptana. Devido ao pequeno tamanho amostral, não pôde ser tirada nenhuma conclusão definitiva sobre o risco de defeitos congênitos após exposição à Cloridrato de Naratriptana.
Cloridrato de Naratriptana somente deve ser utilizado durante a gravidez se o benefício esperado para a mãe for maior do que qualquer possível risco para o feto.
Lactação
A naratriptana e/ou seus metabólitos são secretados no leite de ratas lactantes. Portanto, deve haver cautela ao decidir administrar Cloridrato de Naratriptana em mulheres que estejam amamentando.
Categoria C de risco na gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Qual a ação da substância do Cloridrato de Naratriptana?
Resultados de Eficácia
A eficácia de Cloridrato de Naratriptana foi avaliada em dois estudos, duplo-cegos, placebo-controlados, em pacientes com diagnóstico de enxaqueca com ou sem aura, segundo os critérios do International Headache Society. O alívio da dor em 4 horas ocorreu em ocorreu em 60-68% dos pacientes tratados e foi significativamente superior ao placebo nos dois estudos. A eficácia sobre os sintomas associados (náuseas, fonofobia e fotofobia) também foi significativamente superior ao placebo em ambos os estudos.
Referências Bibliográficas
Mathew NT et al.,Naratriptan is effective and well tolerated in the acute treatment of migraine – results of a double-blind, placebo-controlled, crossover study. Neurology 1997; 49: 1485-1490.
Klassen A et al., Naratriptan is effective and well tolerated in the acute treatment of migraine – results of a double-blind, placebo-controlled, parallel-group study. Headache 1997; 37: 640-645.
Características Farmacológicas
Propriedades Farmacodinâmicas
Mecanismo de Ação
Foi demonstrado que a naratriptana é um agonista seletivo dos receptores da 5-hidroxitriptamina (5-HT1), que mediam a contração vascular. Esses receptores são encontrados, principalmente, em vasos sanguíneos intracranianos (cerebrais e durais). A naratriptana possui alta afinidade pelos receptores 5-HT1B e 5-HT1D clonados de humanos. Supõe-se que o receptor 5-HT1B corresponda ao receptor 5-HT1 vascular, que media a contração dos vasos sanguíneos intracranianos. A naratriptana tem pouco ou nenhum efeito sobre outros subtipos de receptores 5-HT (5-HT2, 5-HT3, 5-HT4 e 5-HT7).
Efeitos Farmacodinâmicos
Em animais, a naratriptana contrai seletivamente a circulação arterial da carótida. Essa circulação fornece sangue aos tecidos extracranianos e intracranianos, como as meninges, antagonizando a dilatação e/ou formação de edema nesses vasos, que é tida como o mecanismo subjacente da enxaqueca no ser humano. Além disto, evidências experimentais sugerem que a naratriptana inibe a atividade nervosa do trigêmeo, contribuindo para o bloqueio central da percepção dolorosa. Ambas as ações contribuem para a ação antienxaqueca da naratriptana.
O tempo estimado de início de ação terapêutica da naratriptana é de 1 hora, e a eficácia máxima é atingida em 4 horas.
Propriedades Farmacocinéticas
Absorção, distribuição, metabolismo e eliminação
Após administração oral, a naratriptana é absorvida rapidamente, com concentrações plasmáticas máximas (Cmáx) observadas após duas a três horas. Após a administração de um comprimido de 2,5 mg de naratriptana, a Cmáx é de aproximadamente 8,3 ng/mL (95% Cl: 6,5 a 10,5 ng/mL) em mulheres, e de 5,4 ng/mL (95% Cl: 4,7 a 6,1 ng/mL) em homens. A biodisponibilidade oral é de 74% em mulheres e 63% em homens, sem diferenças na eficácia e na tolerabilidade quando em uso clínico. Portanto, não é necessário ajuste de dose de acordo com o sexo.
O volume de distribuição da naratriptana é de 170 L. A ligação às proteínas plasmáticas é baixa (29%). A meia-vida de eliminação média (t1/2) é de seis horas. O clearance médio, após administração intravenosa, foi de 470 mL/min em homens, e 380 mL/min em mulheres. O clearance renal de 220 mL/min é similar em homens e mulheres, e é mais alto do que a taxa de filtração glomerular, sugerindo que a naratriptana sofre secreção ativa nos túbulos renais. A excreção predominante da naratriptana ocorre através da urina, com 50% da dose recuperada como droga inalterada e 30% como metabólitos inativos. In vitro, a naratriptana foi metabolizada por uma ampla série de isoenzimas do citocromo P450. Consequentemente, não são previstas interações metabólicas significativas com outras drogas.
Insuficiência renal
A excreção renal é a principal via de eliminação da naratriptana. Por isso, a exposição à naratriptana pode estar aumentada em pacientes com doença renal. Em um estudo os pacientes com insuficiência renal (clearance de creatinina de 18 a 115 mL/min; n=15), pareados por sexo, idade e peso com indivíduos sadios (n=8) l apresentaram aumento de aproximadamente 80% no t1/2, e redução de aproximadamente 50% no clearance.
Insuficiência hepática
O fígado desempenha um papel menor no clearance da naratriptana administrada por via oral. Em um estudo com homens e mulheres com insuficiência hepática (grau Child-Pugh A ou B; n=8), pareados por sexo, idade e peso, com indivíduos sadios que receberam naratriptana por via oral, os pacientes com insuficiência hepática apresentaram um aumento de aproximadamente 40% no t1/2, e uma redução de aproximadamente 30% no clearance.
Variações de acordo com o sexo
Tanto a área sob a curva (ASC) quanto a Cmáx foram, aproximadamente, 35% menores em homens quando comparados às mulheres. Entretanto, não houve diferenças na eficácia e na tolerabilidade durante o uso clínico. Assim, não é necessário um ajuste de dose relacionado ao sexo.
Idosos
Em um mesmo estudo, pacientes idosos saudáveis (n=12) mostraram decréscimo de 26% no clearance em relação a pacientes jovens saudáveis (n=12).
Fontes consultadas
- Bula do Profissional do Medicamento Naramig®.
Doenças relacionadas
O conteúdo desta bula foi extraído manualmente da bula original
SE PERSISTIREM OS SINTOMAS, PROCURE ORIENTAÇÃO DO FARMACÊUTICO OU DE SEU MÉDICO. LEIA A BULA. Todas as informações contidas neste site têm a intenção de informar e educar, não pretendendo, de forma alguma, substituir as orientações de um profissional médico ou servir como recomendação para qualquer tipo de tratamento. Decisões relacionadas ao tratamento de pacientes devem ser tomadas por profissionais autorizados, considerando as características particulares de cada pessoa. Farmacêutica Responsável: Karime Halmenschlager Sleiman CRF/PR nº 39421 Horário de Atendimento: Seg. à Sex. das 08h às 18h. Os preços e promoções divulgados no site são válidos apenas para compras feitas pela internet. A CR trabalha com as tecnologias mais avançadas de proteção de dados, para que você possa realizar suas compras com tranqüilidade. A privacidade e a segurança dos clientes são compromissos da CR. Todos os pedidos efetuados estão sujeitos à confirmação da disponibilidade de produto no estoque dos vendedores.
Formas de pagamento aceitas:
Compra segura e certificados
Garantia CR
Copyright © 2000-2024 Drogarias On Line Agência de Farmácias S.A. – Todos os direitos reservados.
CNPJ n°. 08.434.085/0001-28. / I.E. 90388707-90. Rua Desembagador Vieir
RAMIPRIL
COMPRIMIDO RAMIPRIL
IDENTIFICAÇÃO DO MEDICAMENTO
Naprix A
ramipril + besilato de anlodipino
Cápsulas 2,5 + 5 mg; 5 + 5 mg; 10 + 5 mg; 10 + 10 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Cápsula gelatinosa dura
Embalagens com 30 cápsulas
USO ORAL
USO ADULTO
COMPOSIÇÃO:
Cada cápsula de Naprix A 2,5 + 5 mg contém:
| ramipril base | 2,5 mg |
| besilato de anlodipino (equivalente a 5 mg de anlodipino base) | 6,94 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: carbonato de sódio, hipromelose, sacarose, amido, copovidona, povidona, macrogol, óxido férrico amarelo, dióxido de titânio e gelatina.
Cada cápsula de Naprix A 5 + 5 mg contém:
| ramipril base | 5 mg |
| besilato de anlodipino (equivalente a 5 mg de anlodipino base) | 6,94 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: carbonato de sódio, hipromelose, sacarose, amido, copovidona, povidona, macrogol, óxido férrico amarelo, dióxido de titânio e gelatina.
Cada cápsula de Naprix A 10 + 5 mg contém:
| ramipril base | 10 mg |
| besilato de anlodipino (equivalente a 5 mg de anlodipino base) | 6,94 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: carbonato de sódio, hipromelose, sacarose, amido, copovidona, povidona, macrogol, óxido férrico amarelo, dióxido de titânio e gelatina.
Cada cápsula de Naprix A 10 + 10 mg contém:
| ramipril base | 10 mg |
| besilato de anlodipino (equivalente a 10 mg de anlodipino base) | 13,88 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: carbonato de sódio, hipromelose, sacarose, amido, copovidona, povidona, macrogol, óxido férrico amarelo, dióxido de titânio e gelatina.
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
É indicado para o tratamento de hipertensão arterial (aumento da pressão arterial).
COMO ESTE MEDICAMENTO FUNCIONA?
Naprix A® contém duas substâncias ativas, o besilato de anlodipino e o ramipril, que agem na redução da pressão sanguínea. A hipertensão arterial aumenta a carga de trabalho do coração e das artérias. Se a pressão arterial persistir elevada por muito tempo, o coração e as artérias podem não funcionar adequadamente, levando a dano na parede dos vasos sanguíneos do cérebro, coração e rins, com risco de derrame cerebral, ataque cardíaco ou insuficiência renal. A hipertensão arterial pode aumentar o risco de infarto do coração. O risco de ocorrência desses problemas torna-se menor quando a pressão sanguínea é controlada.
O ramipril bloqueia uma enzima do organismo responsável pela ativação de uma substância que estimula a contração dos vasos sanguíneos, resultando no relaxamento e dilatação desses vasos e, dessa maneira, a pressão sanguínea diminui e aumenta o suprimento de sangue e oxigênio para o coração e todo o corpo. O ramipril também é usado em pacientes que tiveram um ataque cardíaco, pois o músculo do coração pode estar lesado e fraco, dificultando o bombeamento normal de sangue pelo coração. É indicado também para reduzir a chance de ataque cardíaco, derrame cerebral ou morte cardiovascular em pessoas com mais de 55 anos de idade, com diabetes ou doença cardiovascular estabelecida.
O anlodipino é um bloqueador de canal de cálcio utilizado para tratar a angina (dor no peito) e a pressão alta (hipertensão). O anlodipino age no movimento de cálcio dentro das células cardíacas e dos vasos sanguíneos, relaxando a musculatura e aumentando o suprimento de sangue e oxigênio ao coração e aos vasos, enquanto reduz a carga cardíaca. Sua ação proporciona efeitos aditivos aos do ramipril.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Este medicamento é contraindicado para pacientes com reações alérgicas ao ramipril, ao anlodipino, a qualquer componente de sua formulação, a inibidores da enzima de conversão da angiotensina (ECA) e a di-hidropiridínicos. Não deve ser administrado nas seguintes condições: história de edema (inchaço) de face, lábios, língua, glote e/ou laringe; doença renal severa ou diminuição importante da função renal e a pacientes em diálise.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
A presença de outros problemas médicos pode afetar os efeitos deste medicamento. Avise o médico caso você apresente algumas das condições a seguir: desidratação, diarreia ou problema cardíaco; hiponatremia (baixo nível de sódio no sangue); doença renal; doença hepática; insuficiência cardíaca congestiva; pressão sanguínea muito baixa (hipotensão arterial).
Seu médico deve saber se você tem hipertensão arterial grave, utiliza algum outro medicamento para controle da pressão ou sofre de alguma doença do coração. Avise seu médico se sentir dor abdominal intensa, acompanhada ou não de náusea ou vômito; se você tem lúpus, doença no fígado ou nos rins. Avise seu médico ou dentista que você utiliza ramipril, antes de se submeter a qualquer tipo de cirurgia ou antes de exames, antes de tratar alergias, ou se você faz diálise.
Este medicamento pode causar tontura devido à redução da pressão sanguínea; evite dirigir, operar máquinas ou qualquer tipo de tarefa perigosa ou que exija atenção, caso você não esteja se sentindo alerta.
Avise imediatamente o médico em caso de suspeita de infecção ou caso apresente febre ou dor de garganta, desidratação, transpiração excessiva, diarreias ou vômitos, pois poderá perder grande quantidade de líquido e sofrer queda acentuada da pressão sanguínea, podendo ocorrer tontura ou desmaio.
O tratamento com este medicamento necessita de supervisão médica regular; seu médico pode precisar avaliar algumas funções, como: medida regular da pressão sanguínea, principalmente no início do tratamento, após o aumento da dose ou quando da introdução ou aumento da dose de outros anti-hipertensivos; avaliação renal, especialmente nas primeiras semanas de tratamento e, principalmente, em pacientes com doenças ou alterações renais ou em transplantados; níveis de sódio, cálcio, potássio, ácido úrico e açúcar no sangue; níveis de potássio nos pacientes com doença renal ou que utilizam medicamentos poupadores de potássio; níveis de sódio em pacientes que utilizam diuréticos; exame de sangue inicial para controle dos glóbulos brancos; exame de sangue em caso de suspeita de infecção ou sinais de imunodeficiência (febre, amidalite, aumento de gânglios), ou sinais de lesões na pele e mucosas ou sangramento de gengiva. Em caso de inchaço no rosto ou na língua e dificuldade para engolir ou respirar, o médico deverá ser imediatamente avisado e o paciente deve suspender a próxima dose de Naprix A®.
Como os pacientes idosos frequentemente apresentam problemas renais, e devido à alta probabilidade de ocorrência de efeitos adversos, pode ser necessário ajuste de dosagem.
Gravidez e Lactação
Os inibidores da ECA não devem ser usados durante o segundo e o terceiro trimestres de gravidez, pois podem prejudicar o feto. Se ocorrer gravidez na vigência do tratamento, Naprix A® deverá ser descontinuado e o médico, informado. O ramipril aparece no leite materno em quantidades mínimas. O besilato de anlodipino é excretado no leite materno. A proporção de dose recebida pelo bebê pode variar de 3% até 15%. O efeito do anlodipino na criança é desconhecido. Desse modo, a decisão por continuar ou interromper a medicação ou a amamentação deve considerar os benefícios para a mãe e os riscos para o bebê.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Informações importantes sobre um dos componentes do medicamento
Atenção: este medicamento contém AÇÚCAR, portanto, deve ser usado com cautela em portadores de diabetes.
- Cada cápsula de Naprix A® (2,5 mg + 5 mg) contém 0,10 g de SACAROSE.
- Cada cápsula de Naprix A® (5 mg + 5 mg) contém 0,13 g de SACAROSE.
- Cada cápsula de Naprix A® (10 mg + 5 mg) contém 0,19 g de SACAROSE.
- Cada cápsula de Naprix A® (10 mg + 10 mg) contém 0,24 g de SACAROSE.
Interações medicamentosas
Anti-inflamatórios não esteroidais: Raramente, o tratamento concomitante entre inibidores da ECA e anti- inflamatórios não esteroidais tem sido associado à insuficiência renal e ao aumento do nível sanguíneo de potássio.
Diuréticos: Particularmente naqueles pacientes em que a terapia com diuréticos foi recentemente instituída, pode ocorrer redução ocasional e excessiva da pressão sanguínea após o início da terapia com ramipril. A possibilidade dos efeitos hipotensores do ramipril pode ser reduzida ou minimizada pela interrupção temporária do diurético ou aumento da ingestão de líquido antes do início da terapia com ramipril. Caso não seja possível, deve-se iniciar a terapia com a menor dose possível de ramipril.
Suplementos com potássio e poupadores de potássio: O ramipril pode atenuar a perda de potássio causada pelos tiazídicos. Diuréticos poupadores de potássio (espironolactona, amilorida, triantereno, etc.) ou suplementos a base de potássio podem aumentar o risco de hipercalemia. No entanto, se estiver indicado o uso concomitante desses agentes, eles devem ser administrados com cautela, e os níveis sanguíneos de potássio do paciente monitorados periodicamente. Lítio: Pode ocorrer aumento dos níveis sanguíneos do lítio e toxicidade. Esses medicamentos devem ser coadministrados com cautela, e os níveis de lítios devem ser periodicamente monitorados. Se for usado um diurético simultaneamente, o risco de toxicidade do lítio pode aumentar.
Indutores do CYP3A4: O uso concomitante de anlodipino e de indutores fortes da via CYP3A4 do citocromo P450 do fígado, como rifampicina, eritromicina, claritromicina e erva de São João (hypericum perforatum), está associado à variação da concentração do besilato de anlodipino no sangue. Desse modo, deve-se avaliar a pressão sanguínea, pois pode haver necessidade de ajuste da dose do besilato de anlodipino pelo médico, durante e após a utilização conjunta desses medicamentos.
A ingestão de bebidas alcoólicas durante o tratamento pode reduzir o nível de atenção, prejudicando tarefas como operar máquinas e dirigir veículos.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Cuidados de conservação
Este medicamento deve ser armazenado em temperatura ambiente (entre 15°C e 30°C), protegido da luz e da umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
As cápsulas de Naprix A® são transparentes e incolores, com conteúdo de coloração branca e amarela.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
COMO DEVO USAR ESTE MEDICAMENTO?
Naprix A® deve ser tomado conforme as orientações do seu médico. As cápsulas devem ser ingeridas inteiras e sem mastigar com uma quantidade suficiente de líquido (aproximadamente meio copo de água).
Para controle da hipertensão: Complementando o tratamento com Naprix A®, pode ser necessário controlar seu peso corpóreo e cuidados com a alimentação, especialmente com os alimentos com alto teor de sódio (sal). Seu médico deve orientá-lo sobre as possíveis modificações na sua dieta; muitos pacientes que têm pressão alta não apresentam nenhum sinal de problema. Muitos, de fato, não apresentam sintomas. É muito importante que você tome sua medicação exatamente conforme a orientação do seu médico, mesmo que se sinta bem; lembre-se que este medicamento não cura a pressão alta, mas irá auxiliar no seu controle. Pode ser que você tenha que tomar medicação para controle da pressão alta pelo resto da vida. Se a pressão alta não for tratada, poderá causar sérios problemas como infarto do miocárdio, doenças vasculares, derrame cerebral ou doença renal.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Se você se esquecer de tomar uma dose, procure tomá-la assim que possível. Se estiver próximo ao horário da dose seguinte, despreze a dose esquecida e volte ao seu esquema normal. Não tome duas doses ao mesmo tempo.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
ramipril
Estudos clínicos: Reações adversas conforme frequências reportadas em estudos clínicos placebo-controlados realizados com ramipril
Reação comum (≥ 1% e < 10%): dor de cabeça, tontura, fadiga (astenia).
Reação incomum (≥ 0,1% e < 1%): tosse, disfunção erétil (impotência sexual).
Pós-comercialização: Experiência pós-comercialização reportada com ramipril
- Reação incomum (≥ 0,1% e < 1%): Reações anafilatoides, hipotensão sintomática (pressão baixa), síncope (desmaio) e palpitações. Pancitopenia (diminuição global de glóbulos brancos, vermelhos e plaquetas), anemia hemolítica (quebra anormal de hemácias nos vasos sanguíneos) e trombocitopenia (diminuição da quantidade de plaquetas no sangue). Aumento transitório da ureia sanguínea e creatinina, insuficiência renal aguda. Edema angioneurótico; insuficiência hepática, hepatite, icterícia (coloração amarelada dos olhos e pele), pancreatite (inflamação no pâncreas), dor abdominal, anorexia (sensação de apetite diminuído), constipação (prisão de ventre), diarreia, boca seca, dispepsia (indigestão), disfagia (dificuldade de deglutição), gastrenterite (infecção no trato gastrintestinal), salivação aumentada e alteração do paladar. Reações de hipersensibilidade aparente (urticária– coceira, prurido com ou sem febre), fotossensibilidade, púrpura (tipo de hematoma), onicólise (descolamento da unha), pênfigo (aparecimento de bolhas nas mucosas), eritema multiforme (tipo de reação alérgica das mucosas e da pele), necrólise epidérmica tóxica (desprendimento da camada superior da pele), síndrome de Stevens-Johnson (reação alérgica grave, podendo ocorrer nos olhos, nariz, uretra, vagina, trato gastrintestinal e trato respiratório). Ansiedade, amnésia (perda de memória), convulsões, depressão, perda de audição, insônia, nervosismo, neuralgia (dor no nervo), neuropatia (doença no sistema nervoso na qual ocorre uma dor descrita como “picada de agulha” ou “sensação de choque”), parestesia (formigamento), sonolência, tinitus (zumbido no ouvido), tremor, vertigem, distúrbios da visão. Artralgia (dor na articulação), artrite (inflamação na articulação), dispneia (falta de ar), edema (inchaço), epistaxe (sangramento nasal), impotência sexual (disfunção erétil), sudorese aumentada, mal-estar e aumento de peso. Hipoglicemia (baixo nível de glicose no sangue).
besilato de anlodipino
Estudos clínicos: reações adversas conforme frequências reportadas em estudos clínicos placebo-controlados realizados com besilato de anlodipino
- Reação comum (≥ 1% e < 10%): Edema, tontura, flushing (rubor), palpitação, dor de cabeça, fadiga, náusea, dor abdominal, sonolência.
- Reação incomum (≥ 0,1% e < 1%): Insuficiência cardíaca, pulso irregular, extrassistolia (alteração dos batimentos cardíacos), descoloração da pele, urticária (coceira), pele seca, alopecia, dermatite (inflamação na pele causada por alergia), fraqueza muscular, ataxia (falta de coordenação dos movimentos podendo afetar a força muscular e o equilíbrio), hipertonia (aumento da rigidez muscular), enxaqueca, apatia, agitação, amnésia, gastrite, apetite aumentado, tosse, rinite, disúria (dificuldade para urinar), poliúria (aumento do volume urinário), parosmia (sensação de cheiros que não existem ou cheiros desagradáveis), alteração do paladar, distúrbio de acomodação de imagem, xeroftalmia (olho seco).
O besilato de anlodipino pode provocar alterações sérias na pele, como erupção cutânea, urticária, bolhas, prurido (coceira), descamação e edema (inchaço), além de inflamação de mucosas (exemplo: na boca), síndrome de Stevens Johnson, necrose epidérmica tóxica, e outras formas de reações alérgicas. A frequência desse tipo de reação adversa é desconhecida.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Download da bula:
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS nº: 1.0033.0096
Farmacêutica Responsável: Cintia Delphino de Andrade – CRF-SP nº: 25.125
Registrado por:
Libbs Farmacêutica Ltda.
Rua Josef Kryss, 250 – São Paulo – SP
CNPJ 61.230.314/0001-75
Fabricado por:
Libbs Farmacêutica Ltda.
Rua Alberto Correia Francfort, 88 – Embu das Artes – SP
Indústria Brasileira
Pressão Alta
O que é Hipertensão?
A hipertensão arterial sistêmica (HAS), também chamada de pressão alta, é uma condição caracterizada por níveis continuamente elevados de pressão sanguínea nas artérias.
Uma pessoa é considerada hipertensa quando a sua pressão fica maior ou igual a 14 por 9 (140/90mmHg) na maior parte do tempo. Segundo a Pesquisa Nacional de Saúde, do IBGE, essa era a realidade de cerca de 24% dos brasileiros com mais de 18 anos em 2019.
Os valores representam a força com que o sangue passa pelas artérias em dois momentos: quando o coração contrai (sístole) e quando relaxa (diástole). Por convenção, a unidade de medida usada neste caso é milímetros de mercúrio (mmHg).
Assim, quem está com um índice de 12 por 8 apresenta uma pressão nas artérias de 120 mmHg durante a sístole e 80 mmHg durante a diástole.
Pressão alta na gravidez
A hipertensão pode ser especialmente perigosa durante a gestação, oferecendo riscos não só à mulher, mas também ao feto, já que ela altera o fluxo sanguíneo na placenta.
Entre as possíveis consequências estão a redução da quantidade de oxigênio que chega até o bebê em formação e o aumento do risco de convulsões para a mãe na hora do parto. Por isso, é muito importante que a grávida sempre acompanhe as suas taxas de pressão, além de tomar alguns cuidados especiais para a prevenção.
Saiba mais: qual é o melhor chá para pressão alta?
Causas
A hipertensão normalmente ocorre quando há resistência ou endurecimento dos vasos sanguíneos para a passagem do sangue – o que necessita de uma força maior do coração para bombardeá-lo. Isso pode ser um processo natural do corpo, mas é aumentado com alguns dos fatores de risco, como o consumo excessivo de sal (acima de 5 gramas diárias).
Tipos
A doença pode ser dividida basicamente em três estágios, sendo o primeiro o mais leve e o último o mais grave, de acordo com os níveis de pressão arterial dos pacientes:
- Estágio I: acima de 140/90 mmHg e abaixo de 159/99 mmHg;
- Estágio II: acima de 160/100 mmHg e abaixo de 179/109 mmHg;
- Estágio III: acima de 180/110 mmHg.
Existe ainda a hipertensão sistólica isolada, que é quando a pressão sistólica está elevada (acima de 140 mmHg), mas a diastólica está normal (abaixo de 90 mmHg).
Sintomas
A hipertensão na maioria das vezes é assintomática, mas pode provocar:
- Dor no peito;
- Dor de cabeça;
- Tontura;
- Zumbido no ouvido;
- Visão turva;
- Fraqueza;
- Sangramento nasal.
Diagnóstico
O diagnóstico costuma ser feito a partir de exames que medem a pressão e, de acordo com o cardiologista César Jardim, do Hcor, o ideal é que eles sejam realizados esporadicamente, mesmo que a pessoa não apresente nenhum sintoma, para garantir a detecção precoce da doença.
Saiba mais: 15 maneiras de prevenir e controlar a pressão alta
A hipertensão é herdada dos pais em 90% dos casos, conforme afirma o Ministério da Saúde. Em uma minoria, ela pode ser causada por medicamentos ou uma doença relacionada, como distúrbios da tireoide ou em glândulas endocrinológicas, como a suprarrenal.
O mais comum é ouvir que a pressão alta foi causada pelo consumo excessivo de sal, mas muita gente não sabe por que isso acontece. Basicamente, esse mineral estimula o aumento da quantidade de água nos vasos sanguíneos para manter a concentração do sangue equilibrada – o que eleva o volume de líquido que corre pelas artérias e, inevitavelmente, a pressão dentro delas.
Entretanto, há vários outros fatores que podem favorecer a doença, entre eles:
- Consumo de bebidas alcoólicas;
- Obesidade;
- Tabagismo;
- Estresse;
- Colesterol alto;
- Diabetes;
- Idade avançada;
- Gênero e etnia (maior em homens e em indivíduos não-brancos);
- Sedentarismo.
Saiba mais: diabetes e hipertensão: como conviver com ambos?
Exames
Para o diagnóstico, o mais comum é que um profissional de saúde meça a pressão com um aparelho chamado esfigmomanômetro (ou tensiômetro). O grande problema é que esse método algumas vezes causa algum grau de ansiedade no paciente – o que eleva a pressão de forma desproporcional ao valor diário.
Para evitar que isso aconteça, em alguns casos, o médico pede um exame chamado MAPA (Monitorização Ambulatorial da Pressão Arterial) em que a pessoa deve usar um aparelho que mede cerca de cem vezes a pressão arterial durante 24 horas.
Também pode ser feita a Monitorização Residencial da Pressão Arterial (MRPA), ou seja, a medida com o aparelho que o próprio paciente tem em casa. Para garantir a sua eficácia, é essencial seguir o seguinte passo a passo:
- Esteja em repouso por pelo menos dois minutos (idealmente cinco minutos);
- Fique na posição sentada;
- Esteja de bexiga vazia (para evitar que a distensão de bexiga cause desconforto e eleve a pressão);
- Prefira momentos em que você ou a pessoa que está medindo a pressão esteja sem dor ou ansiedade extrema;
- Posicione o braço na altura do coração, apoiado em alguma superfície;
- Coloque o aparelho medidor nem muito apertado e nem muito solto, permitindo a entrada de um dedo;
- Evite falar durante a medição;
- Meça duas vezes, com cinco minutos de intervalo, para ter certeza da medida.
Vale destacar que a aferição sempre deve ser feita com tensiômetro, seja ele manual ou automático. Os aplicativos que prometem realizar essa mesma função com apenas a colocação do dedo na câmera do celular ou no identificador digital ainda não têm efeito garantido por estudos científicos.
Fato é que, independentemente do método utilizado, os valores aferidos em indivíduos acima de 18 anos classificam-se como:
- Ótimos: até 120/80 mmHg;
- Normais: entre 120/80 e 130/85 mmHg;
- Limítrofes: entre 130/85 e 139/89 mmHg;
- Hipertensos: acima de 140/90 mmHg.
Buscando ajuda médica
Especialistas que podem diagnosticar hipertensão são:
- Clínico geral;
- Cardiologista;
- Cirurgião vascular.
Tratamento
O grande foco do tratamento é controlar a doença, visando uma melhora da qualidade de vida e a prevenção de complicações.
Somente o médico poderá determinar o que é mais adequado para cada paciente, considerando as comorbidades e as medidas da pressão. Contudo, o tratamento, de forma geral, inicia-se com a mudança do estilo de vida associado ou não ao uso de medicamentos.
Os especialistas recomendam:
- Manter o peso adequado;
- Não abusar do sal;
- Praticar atividade física regular;
- Aproveitar momentos de lazer;
- Abandonar o fumo;
- Moderar o consumo de álcool;
- Evitar alimentos gordurosos;
- Controlar o diabetes e outras comorbidades.
Quando a doença surge em decorrência de alguma outra, também é essencial que a causa inicial seja tratada.
Saiba mais: conheça a dieta criada para tratar a hipertensão
Por que não abandonar o tratamento?
Esse é um dos maiores problemas no tratamento da hipertensão: a falta de adesão e a ideia equivocada de que, uma vez que a pressão arterial esteja controlada, a medicação pode ser suspensa.
A realidade é muito diferente. Um paciente hipertenso que abandona o tratamento fica sujeito a uma elevação súbita da pressão e aos riscos de ter problemas relacionados, como AVC, infarto agudo do miocárdio, doença renal crônica e insuficiência cardíaca.
“O paciente só está autorizado a diminuir a dose ou eventualmente suspender o tratamento, quando a pressão tende a ficar muito baixa – o que só pode ser determinado por um especialista”, alerta o cardiologista César Jardim.
Leia também: chás para pressão alta: descubra qual realmente funciona
Medicamentos
Existem diferentes tipos de remédios para hipertensão, incluindo:
- Inibidores da enzima conversora da angiotensina: eles impedem a angiotensina I de se converter em angiotensina II, sendo esta última responsável pelo aumento da pressão arterial;
- Antagonistas dos receptores da angiotensina (ARA): bloqueiam a ação da angiotensina II em um dos receptores que eles atuam;
- Betabloqueadores: agem no sistema nervoso simpático, que tem como uma das funções reagir ao estresse e pode elevar a pressão arterial;
- Diuréticos: aumentam a excreção de água e sódio do organismo e também têm ação vasodilatadora, reduzindo a pressão sanguínea;
- Antagonistas de cálcio: eles bloqueiam a ação do canal de cálcio com consequente dilatação das artérias.
Os nomes de alguns deles são:
- Aldactone;
- Apresolina;
- Aradois;
- Atenolol;
- Atenolol + Clortalidona;
- Atensina;
- Besilato de Anlodipino;
- Benicar;
- Clortalidona;
- Co-Pressotec;
- Captopril;
- Captopril + Hidroclorotiazida;
- Cardizem;
- Carvedilol;
- Concor;
- Coreg;
- Cozaar;
- Diovan;
- Diurix;
- Doxazosina;
- Duomo;
- Enalapril + Hidroclorotiazida;
- Enalapril;
- Espironolacton;
- Furosemida;
- Hidroclorotiazida;
- Higroton;
- Indapen SR;
- Lasix;
- Lisinopril;
- Losartana Potássica;
- Losartana Potássica + Hidroclorotiazida;
- Metildopa;
- Nebilet.
Dependendo da situação, pode ser necessário usar mais de um tipo para controlar a doença de forma eficaz, mas apenas um médico poderá determinar isso, assim como a dosagem correta e a duração do tratamento.
Tem cura?
A hipertensão arterial não tem cura na maior parte dos casos. A cura pode acontecer quando a hipertensão surge em decorrência de alguma outra doença ou do uso de algum medicamento.
Prevenção
Para prevenir a hipertensão, é recomendado que as pessoas em idade adulta meçam a pressão pelo menos uma vez por ano como forma de acompanhamento. Se houver casos de hipertensão na família, o número aumenta para duas vezes ao ano.
Além disso, pode ajudar manter hábitos de vida mais saudáveis, como:
- Diminuir ou abandonar o consumo de bebidas alcoólicas;
- Tentar levar os problemas do dia a dia de maneira mais tranquila;
- Manter o peso saudável;
- Praticar atividades físicas regularmente;
- Ter uma alimentação saudável;
- Diminuir o consumo de sal.
Saiba mais: 15 maneiras de prevenir e controlar a hipertensão
Complicações possíveis
Como a hipertensão aumenta a sobrecarga imposta ao coração e danifica os vasos sanguíneos, ela pode prejudicar várias partes do corpo. Uma delas é o próprio sistema cardiovascular, resultando muitas vezes em quadros de AVC, infarto agudo do miocárdio e arritmia cardíaca.
A condição ainda é capaz de levar à doença renal crônica por tornar os vasos dos rins mais espessos e rígidos – o que prejudica a realização de suas funções.
Se mal irrigados, até os olhos podem sair prejudicados, ficando com algo conhecido como retinopatia hipertensiva, que, em casos mais graves, provoca cegueira.
Referências
Sociedade Brasileira de Hipertensão
Sociedade Brasileira de Cardiologia
Pesquisa Nacional de Saúde 2019 (PNS 2019) – Instituto Nacional de Geografia e Estatpistica (IBGE)
César Jardim, cardiologista do Hcor
Weimar Sebba Barroso, cardiologista presidente do Departamento de Hipertensão da SBC – Sociedade Brasileira de Cardiologia
Marly Uellendahl, cardiologista do Lavoisier Medicina Diagnóstica.
Rivaroxabana
Para que serve o remédio rivaroxabana 10 mg?
Rivaroxabana é indicada para o tratamento de trombose nas veias profundas e prevenção de trombose nas veias profundas e embolia pulmonar recorrentes, em adultos. Rivaroxabana é indicada para o tratamento de embolia pulmonar e para prevenção de embolia pulmonar e trombose nas veias profundas recorrentes, em adultos.
Comprimido 10mg / 15mg / 20mg
Rivaroxabana é indicado para o tratamento de trombose venosa profunda (TVP) e prevenção de trombose venosa profunda (TVP) e embolia pulmonar (EP) recorrentes, em adultos.
Rivaroxabana é indicado para o tratamento de embolia pulmonar (EP) e prevenção de embolia pulmonar (EP) e trombose venosa profunda (TVP) recorrentes, em adultos.
Exclusivo Comprimido 10mg
Rivaroxabana é indicado para a prevenção de tromboembolismo venoso (TEV) em pacientes adultos submetidos à cirurgia eletiva de artroplastia de joelho ou quadril.
Exclusivo Comprimido 15mg / 20mg
Rivaroxabana é indicado para prevenção de acidente vascular cerebral e embolia sistêmica em pacientes adultos com fibrilação atrial não-valvular que apresente um ou mais fatores de risco, como insuficiência cardíaca congestiva, hipertensão, 75 anos de idade ou mais, diabetes mellitus, acidente vascular cerebral ou ataque isquêmico transitório anteriores.
Quais as contraindicações do Rivaroxabana?
Rivaroxabana é contraindicado em pacientes com hipersensibilidade à rivaroxabana ou a qualquer outro componente do produto; em pacientes com sangramento ativo clinicamente significativo (por exemplo, sangramento intracraniano, sangramento gastrintestinal); e ainda em pacientes com doença hepática associada à coagulopatia, levando a um risco de sangramento clinicamente relevante, incluindo pacientes cirróticos com Child Pugh B e C (15mg e 20mg).
Não foram estabelecidas segurança e eficácia de Rivaroxabana em mulheres grávidas. Dados em animais mostram que a rivaroxabana atravessa a barreira placentária. Portanto, o uso de Rivaroxabana é contraindicado durante toda a gravidez.
Não foram estabelecidas segurança e eficácia de Rivaroxabana em mulheres lactantes. Dados em animais indicam que a rivaroxabana é secretada no leite materno. Portanto, Rivaroxabana só pode ser administrado depois que for descontinuada a amamentação.
Como usar o Rivaroxabana?
Comprimido 10mg
Dosagem e método de administração: Prevenção de TEV
Método de administração
Uso oral.
Dose usual recomendada
A dose recomendada para prevenção de TEV em cirurgia ortopédica é um comprimido de 10 mg uma vez ao dia, com ou sem alimento.
Duração do tratamento
A duração do tratamento depende do tipo de cirurgia ortopédica.
Após cirurgia de grande porte do quadril, os pacientes devem ser tratados por 5 semanas.
Após cirurgia de grande porte do joelho, os pacientes devem ser tratados por 2 semanas.
Método e frequência da administração
A dose inicial deve ser tomada 6 a 10 horas após a cirurgia, contanto que tenha sido estabelecida a hemostasia.
Para pacientes que não conseguem engolir comprimidos inteiros, o comprimido de Rivaroxabana pode ser triturado e misturado com água ou alimentos pastosos, como purê de maçã, imediatamente antes da utilização, e administrado por via oral.
O comprimido de Rivaroxabana triturado pode ser administrado por sonda gástrica. Deve-se confirmar o posicionamento da sonda gástrica antes de administrar Rivaroxabana. O comprimido triturado deve ser administrado em uma pequena quantidade de água através de uma sonda gástrica, que deve ser lavada com água após a administração.
Doses esquecidas
Em caso de esquecimento da tomada de um comprimido, o paciente deverá tomar a dose de 10 mg de Rivaroxabana assim que se lembrar e, no dia seguinte, continuar tomando o comprimido uma vez ao dia, como antes.
Dosagem e método de administração no tratamento e prevenção de TVP e EP recorrentes
Método de administração
Uso oral.
Dose usual recomendada
A dose recomendada para o tratamento inicial de TVP e EP agudos é de 15 mg de Rivaroxabana duas vezes ao dia para as três primeiras semanas, seguido por 20 mg de Rivaroxabana uma vez ao dia para a continuação do tratamento e para a prevenção da TVP e de EP recorrentes.
Após a conclusão de pelo menos 6 meses de tratamento para TVP ou EP, Rivaroxabana 10 mg uma vez ao dia ou Rivaroxabana 20 mg uma vez ao dia é recomendado com base em uma avaliação de risco individual de TVP ou EP recorrente em relação ao risco de sangramento.
Duração do tratamento
Para TVP e EP, a duração do tratamento deve ser individualizada após cuidadosa avaliação do benefício do tratamento contra o risco de sangramento. A terapia de curta duração (3 meses) deve ser considerada em pacientes com TVP ou EP provocada pelos principais fatores de risco transitórios (por exemplo, cirurgia importante recente ou trauma).
A terapia de longa duração deve ser considerada em pacientes com TVP ou EP provocada por fatores de risco permanentes, TVP ou EP não provocada, ou história de TVP ou EP recorrente.
Método e frequência da administração
Durante as primeiras 3 semanas de tratamento agudo, Rivaroxabana 15 mg deve ser tomado 2 vezes ao dia.
Após as primeiras 3 semanas, o tratamento com Rivaroxabana deve ser continuado com 20 mg uma vez ao dia.
Após pelo menos 6 meses de tratamento, Rivaroxabana 10 mg ou 20 mg deve ser tomado uma vez ao dia.
Rivaroxabana 10 mg pode ser tomado com ou sem alimentos.
Para pacientes que não conseguem engolir comprimidos inteiros, o comprimido de Rivaroxabana pode ser triturado e misturado com água ou alimentos pastosos, como purê de maçã, imediatamente antes da utilização, e administrado por via oral. O comprimido de Rivaroxabana triturado pode ser administrado por sonda gástrica.
Deve-se confirmar o posicionamento da sonda gástrica antes de administrar Rivaroxabana. O comprimido triturado deve ser administrado em uma pequena quantidade de água através de uma sonda gástrica, que deve ser lavada com água após a administração.
Doses esquecidas
É essencial aderir ao esquema de dose recomendado.
Se for esquecida uma dose durante a fase de tratamento com uma ingestão ao dia, o paciente deve tomar Rivaroxabana imediatamente e continuar no dia seguinte com uma ingestão ao dia, conforme recomendado. A dose não deve ser dobrada no mesmo dia para compensar uma dose perdida.
Dose diária máxima
A dose diária máxima recomendada é de 30 mg durante as três semanas iniciais do tratamento. Na fase de continuação do tratamento a dose diária máxima recomendada é de 20 mg.
Informações adicionais para populações especiais
Pacientes com insuficiência hepática
Rivaroxabana é contraindicado em pacientes com doença hepática associada à coagulopatia, levando a um risco de sangramento clinicamente relevante.
Não é necessário ajuste de dose em pacientes com outras doenças hepáticas.
Dados clínicos limitados em pacientes com insuficiência hepática moderada (Child Pugh B) indicam aumento significativo da atividade farmacológica. Não existem dados clínicos disponíveis para pacientes com insuficiência hepática grave (Child Pugh C).
Pacientes com insuficiência renal
Para prevenção de TEV não é necessário ajuste de dose se a rivaroxabana for administrada em pacientes com insuficiência renal leve (depuração de creatinina ClCr ≤ 80-50 mL/min) ou moderada (ClCr < 50-30 mL/min);
Para tratamento e prevenção de TVP e EP recorrentes não é necessário ajuste de dose em pacientes com insuficiência renal leve (depuração de creatinina (ClCr): ≤ 80-50 mL/min). O tratamento para pacientes com insuficiência renal moderada (depuração de creatinina (ClCr): < 50–30 mL/min) ou grave (depuração de creatinina (ClCr): < 30-15 mL/min) deve ser 15 mg duas vezes ao dia durante as três primeiras semanas. Posteriormente, quando a dose recomendada é de 20 mg uma vez por dia, a redução de dose de 20 mg uma vez por dia para 15 mg uma vez por dia deve ser considerada, se o risco de sangramento do paciente avaliado supera o risco de TVP e EP recorrente. A recomendação para o uso de 15 mg é baseada em modelo de Farmacocinética e não foi estudada em cenário clínico. Quando a dose recomendada é de 10 mg uma vez por dia, não é necessário ajuste de dose.
Dados clínicos limitados para pacientes com insuficiência renal grave (ClCr < 30-15 mL/min) indicam que os níveis plasmáticos de rivaroxabana aumentam significativamente nesta população de pacientes. Portanto, Rivaroxabana deve ser utilizado com cautela nestes pacientes.
O uso de Rivaroxabana não é recomendado para pacientes com ClCr <15 mL/min.
Convertendo de antagonistas de vitamina K (AVK) para Rivaroxabana
Para tratamento e prevenção de TVP e EP recorrentes o tratamento com AVK deve ser interrompido e iniciado com Rivaroxabana assim que os valores de RNI forem < 2,5.
Em pacientes convertidos de AVKs para Rivaroxabana, os valores de RNI serão falsamente elevados após administração de Rivaroxabana. A medida de RNI não é válida para medir a atividade anticoagulante de Rivaroxabana e desta forma, não deve ser usada para este fim.
Convertendo de Rivaroxabana para antagonistas de vitamina K (AVK)
Existe um potencial para anticoagulação inadequada durante a transição de Rivaroxabana para AVK. A anticoagulação adequada contínua deve ser assegurada durante qualquer transição para um anticoagulante alternativo. Deve ser observado que Rivaroxabana pode contribuir para um valor elevado de RNI.
Em pacientes convertidos de Rivaroxabana para AVK, o AVK deve ser administrado concomitantemente até que o valor de RNI seja ≥ 2,0. Para os dois primeiros dias do período de conversão, a dose padrão de AVK deve ser utilizada seguida pela dose de AVK ajustada de acordo com os testes de RNI. Enquanto os pacientes receberem ambos, Rivaroxabana e AVK, a medida de RNI não deve ser realizada antes de 24 horas (após a dose anterior, mas antes da próxima dose de Rivaroxabana).
Com a descontinuação de Rivaroxabana, o teste de RNI pode ser feito de forma confiável 24 horas após a última dose.
Convertendo de anticoagulantes parenterais para Rivaroxabana
Para pacientes que estejam atualmente recebendo um anticoagulante parenteral, Rivaroxabana deve ser iniciado 0 a 2 horas antes do horário previsto para próxima administração do medicamento parenteral (por exemplo, heparina de baixo peso molecular) ou no momento da descontinuação da administração parenteral contínua do medicamento (por exemplo, heparina não fracionada intravenosa).
Convertendo de Rivaroxabana para anticoagulantes parenterais
Descontinue o uso de Rivaroxabana e administre a primeira dose do anticoagulante parenteral no momento em que a próxima dose de Rivaroxabana seria administrada.
Crianças e adolescentes (do nascimento aos 18 anos)
A segurança e eficácia não foram estabelecidas em crianças e adolescentes com idade inferior a 18 anos.
Pacientes idosos
Não é necessário ajuste de dose com base na idade do paciente.
Gênero
Não é necessário ajuste de dose com base no sexo do paciente.
Peso corporal
Não é necessário ajuste de dose baseado no peso corporal do paciente.
Diferenças étnicas
Não é necessário ajuste de dose com base em diferenças étnicas.
Comprimido 15mg / 20mg
Dosagem e método de administração: Prevenção de acidente vascular cerebral e embolia sistêmica em pacientes com fibrilação atrial não-valvular
Método de administração
Uso oral.
Dose usual recomendada
A dose recomendada é de 20 mg uma vez ao dia.
Duração do tratamento
A terapia deve ser continuada enquanto os fatores de risco para AVC e embolia sistêmica persistirem.
Método e frequência da administração
Deve ser ingerido um comprimido de 20 mg de Rivaroxabana por dia. Rivaroxabana 20 mg e Rivaroxabana 15 mg devem ser ingeridos com alimentos.
Para pacientes que não conseguem engolir comprimidos inteiros, o comprimido de Rivaroxabana pode ser triturado e misturado com água ou alimentos pastosos, como purê de maçã, imediatamente antes da utilização, e administrado por via oral. Após a administração do comprimido triturado de Rivaroxabana 15 mg ou de Rivaroxabana 20 mg, a dose deve ser imediatamente seguida por alimento.
O comprimido de Rivaroxabana triturado pode ser administrado por sonda gástrica. Deve-se confirmar o posicionamento da sonda gástrica antes de administrar Rivaroxabana. O comprimido triturado deve ser administrado em uma pequena quantidade de água através de uma sonda gástrica, que deve ser lavada com água após a administração. Após a administração do comprimido triturado de Rivaroxabana 15 mg ou de Rivaroxabana 20 mg, a dose deve ser imediatamente seguida por nutrição enteral.
Doses esquecidas
Em caso de esquecimento de uma dose, o paciente deve tomar Rivaroxabana imediatamente e continuar com a tomada uma vez ao dia, conforme recomendado, no dia seguinte.
Não deve ser tomada dose em dobro para compensar uma dose esquecida dentro do mesmo dia.
Dose diária máxima
A dose máxima recomendada diariamente é 20 mg.
Informações adicionais para populações especiais
Pacientes com insuficiência hepática
Rivaroxabana é contraindicado em pacientes com doença hepática associada à coagulopatia e risco de sangramento clinicamente relevante, incluindo pacientes cirróticos com Child Pugh B e C.
Pacientes com insuficiência renal
Não é necessário ajuste de dose em pacientes com insuficiência renal leve (depuração de creatinina (ClCr): ≤ 80-50 mL/min). Para pacientes com insuficiência renal moderada (depuração de creatinina (ClCr): < 50-30 mL/min) ou grave (depuração de creatinina (ClCr): < 30-15 mL/min) a dose recomendada é de 15 mg uma vez ao dia.
Dados clínicos limitados para pacientes com insuficiência renal grave (ClCr: < 30-15 mL/min) indicam que as concentrações plasmáticas da rivaroxabana são significativamente aumentadas, portanto, Rivaroxabana deve ser utilizado com precaução nestes pacientes.
O uso de Rivaroxabana não é recomendado em pacientes com ClCr < 15 mL/min.
Convertendo de antagonistas de vitamina K (AVK) para Rivaroxabana
O tratamento com AVK deve ser interrompido e iniciada a terapia com Rivaroxabana assim que o valor de RNI for < 3,0.
Em pacientes convertidos de AVKs para Rivaroxabana, os valores de RNI serão falsamente elevados após a ingestão de Rivaroxabana. O RNI não é válido para medir a atividade anticoagulante de Rivaroxabana, e desta forma não deve ser usado para este fim.
Convertendo de Rivaroxabana para antagonistas de vitamina K (AVK)
Existe um potencial para anticoagulação inadequada durante a transição de Rivaroxabana para AVK. A anticoagulação adequada contínua deve ser assegurada durante qualquer transição para um anticoagulante alternativo. Deve ser observado que Rivaroxabana pode contribuir para um valor elevado de RNI.
Em pacientes convertidos de Rivaroxabana para AVK, o AVK deve ser administrado concomitantemente até que o valor de RNI seja ≥ 2,0. Para os dois primeiros dias do período de conversão, a dose padrão de AVK deve ser utilizada seguida pela dose de AVK ajustada de acordo com os testes de RNI. Enquanto os pacientes receberem ambos, Rivaroxabana e AVK, a medida de RNI não deve ser realizada antes de 24 horas (após a dose anterior, mas antes da próxima dose de Rivaroxabana).
Com a descontinuação de Rivaroxabana, o teste de RNI pode ser feito de forma confiável 24 horas após a última dose.
Convertendo de anticoagulantes parenterais para Rivaroxabana
Para pacientes que estejam atualmente recebendo um anticoagulante parenteral, Rivaroxabana deve ser iniciado 0 a 2 horas antes do horário previsto para próxima administração do medicamento parenteral (por exemplo, heparina de baixo peso molecular) ou no momento da descontinuação da administração parenteral contínua do medicamento (por exemplo, heparina não fracionada intravenosa).
Convertendo de Rivaroxabana para anticoagulantes parenterais
Descontinue o uso de Rivaroxabana e administre a primeira dose do anticoagulante parenteral no momento em que a próxima dose de Rivaroxabana seria administrada.
Pacientes submetidos a Intervenção Coronária Percutânea (ICP) com colocação de stent
Os pacientes com fibrilação atrial não-valvular submetidos a ICP com colocação de stent devem receber uma dose reduzida de 15 mg de Rivaroxabana uma vez ao dia (ou 10 mg de Rivaroxabana uma vez ao dia para pacientes com insuficiência renal moderada [ClCr: <50-30 mL/min]) associado a um inibidor de P2Y12 (e.x.: clopidogrel).
Este regime de tratamento é recomendado por no máximo 12 meses após a ICP com colocação de stent.
Após o término da terapia antiplaquetária, a dose de rivaroxabana deve ser aumentada para a dose padrão para pacientes com fibrilação atrial não-valvular.
Crianças e adolescentes (do nascimento aos 18 anos)
A segurança e eficácia não foram estabelecidas em crianças e adolescentes com idade inferior a 18 anos.
Pacientes idosos
Não é necessário ajuste de dose com base na idade do paciente.
Gênero
Não é necessário ajuste de dose com base no sexo do paciente.
Peso corporal
Não é necessário ajuste de dose baseado no peso corporal do paciente.
Diferenças étnicas
Não é necessário ajuste de dose com base em diferenças étnicas.
Dosagem e método de administração no tratamento e prevenção de TVP e EP recorrentes
Método de administração
Uso oral.
Dose usual recomendada
A dose recomendada para o tratamento inicial de TVP e EP agudos é de 15 mg de Rivaroxabana duas vezes ao dia para as três primeiras semanas, seguido por 20 mg de Rivaroxabana uma vez ao dia para a continuação do tratamento e para a prevenção da TVP e de EP recorrentes.
Após a conclusão de pelo menos 6 meses de tratamento para TVP ou EP, Rivaroxabana 10 mg uma vez ao dia ou Rivaroxabana 20 mg uma vez ao dia é recomendado com base em uma avaliação de risco individual de TVP ou EP recorrente em relação ao risco de sangramento.
Duração do tratamento
Para TVP e EP, a duração do tratamento deve ser individualizada após cuidadosa avaliação do benefício do tratamento contra o risco de sangramento. A terapia de curta duração (3 meses) deve ser considerada em pacientes com TVP ou EP provocada pelos principais fatores de risco transitórios (por exemplo, cirurgia importante recente ou trauma).
A terapia de longa duração deve ser considerada em pacientes com TVP ou EP provocada por fatores de risco permanentes, TVP ou EP não provocada, ou história de TVP ou EP recorrente.
Método e frequência da administração
Durante as primeiras 3 semanas de tratamento agudo, Rivaroxabana 15 mg deve ser tomado 2 vezes ao dia.
Após as primeiras 3 semanas, o tratamento com Rivaroxabana deve ser continuado com 20 mg uma vez ao dia.
Após pelo menos 6 meses de tratamento, Rivaroxabana 10 mg ou 20 mg deve ser tomado uma vez ao dia.
Rivaroxabana 15 mg e Rivaroxabana 20 mg devem ser tomados junto com alimentos. Rivaroxabana 10 mg pode ser tomado com ou sem alimentos.
Para pacientes que não conseguem engolir comprimidos inteiros, o comprimido de Rivaroxabana pode ser triturado e misturado com água ou alimentos pastosos, como purê de maçã, imediatamente antes da utilização, e administrado por via oral. Após a administração do comprimido triturado de Rivaroxabana 15 mg ou de Rivaroxabana 20 mg, a dose deve ser imediatamente seguida por alimento. O comprimido de Rivaroxabana triturado pode ser administrado por sonda gástrica.
Deve-se confirmar o posicionamento da sonda gástrica antes de administrar Rivaroxabana. O comprimido triturado deve ser administrado em uma pequena quantidade de água através de uma sonda gástrica, que deve ser lavada com água após a administração. Após a administração do comprimido triturado de Rivaroxabana 15 mg ou de Rivaroxabana 20 mg, a dose deve ser imediatamente seguida por nutrição enteral.
Doses esquecidas
É essencial aderir ao esquema de dose recomendado.
Se for esquecida uma dose durante a fase de tratamento com 15 mg duas vezes ao dia (dia 1 – 21), o paciente deve tomar Rivaroxabana imediatamente para garantir a ingestão de 30 mg por dia do medicamento. Nesse caso, dois comprimidos de 15 mg podem ser tomados de uma só vez. O paciente deve continuar tomando a dose regular de 15 mg duas vezes ao dia no dia seguinte, conforme recomendado.
Se for esquecida uma dose durante a fase de tratamento com uma ingestão ao dia, o paciente deve tomar Rivaroxabana imediatamente e continuar no dia seguinte com uma ingestão ao dia, conforme recomendado. A dose não deve ser dobrada no mesmo dia para compensar uma dose perdida.
Dose diária máxima
A dose diária máxima recomendada é de 30 mg durante as três semanas iniciais do tratamento. Na fase de continuação do tratamento a dose diária máxima recomendada é de 20 mg.
Informações adicionais para populações especiais
Pacientes com insuficiência hepática
Rivaroxabana é contraindicado em pacientes com doença hepática associada à coagulopatia e risco de sangramento clinicamente relevante, incluindo pacientes cirróticos com Child Pugh B e C.
Pacientes com insuficiência renal
Não é necessário ajuste de dose em pacientes com insuficiência renal leve (depuração de creatinina (ClCr): ≤ 80-50 mL/min).
O tratamento para pacientes com insuficiência renal moderada (depuração de creatinina (ClCr): < 50–30 mL/min) ou grave (depuração de creatinina (ClCr): < 30-15 mL/min) deve ser 15 mg duas vezes ao dia durante as três primeiras semanas. Posteriormente, quando a dose recomendada é de 20 mg uma vez por dia, a redução de dose de 20 mg uma vez por dia para 15 mg uma vez por dia deve ser considerada, se o risco de sangramento do paciente avaliado supera o risco de TVP e EP recorrente. A recomendação para o uso de 15 mg é baseada em modelo de Farmacocinética e não foi estudada em cenário clínico.
Quando a dose recomendada é de 10 mg uma vez por dia, não é necessário ajuste de dose. Dados clínicos limitados para pacientes com insuficiência renal grave (ClCr < 30-15 mL/min) indicam que as concentrações plasmáticas de rivaroxabana aumentam significativamente, portanto, Rivaroxabana deve ser utilizado com cautela nestes pacientes.
O uso de Rivaroxabana não é recomendado para pacientes com ClCr < 15 mL/min.
Convertendo de antagonistas de vitamina K (AVK) para Rivaroxabana
O tratamento com AVK deve ser interrompido e iniciado com Rivaroxabana assim que os valores de RNI forem < 2,5.
Em pacientes convertidos de AVKs para Rivaroxabana, os valores de RNI serão falsamente elevados após a administração de Rivaroxabana. A medida de RNI não é válida para medir a atividade anticoagulante de Rivaroxabana, e desta forma não deve ser usada para este fim.
Convertendo de Rivaroxabana para antagonistas de vitamina K (AVK)
Existe um potencial para anticoagulação inadequada durante a transição de Rivaroxabana para AVK. A anticoagulação adequada contínua deve ser assegurada durante qualquer transição para um anticoagulante alternativo. Deve ser observado que Rivaroxabana pode contribuir para um valor elevado de RNI.
Em pacientes convertidos de Rivaroxabana para AVK, o AVK deve ser administrado concomitantemente até que o valor de RNI seja ≥ 2,0. Para os dois primeiros dias do período de conversão, a dose padrão de AVK deve ser utilizada seguida pela dose de AVK ajustada de acordo com os testes de RNI. Enquanto os pacientes receberem ambos, Rivaroxabana e AVK, a medida de RNI não deve ser realizada antes de 24 horas (após a dose anterior, mas antes da próxima dose de Rivaroxabana).
Com a descontinuação de Rivaroxabana, o teste de RNI pode ser feito de forma confiável 24 horas após a última dose.
Convertendo de anticoagulantes parenterais para Rivaroxabana
Para pacientes que estejam atualmente recebendo um anticoagulante parenteral, Rivaroxabana deve ser iniciado 0 a 2 horas antes do horário previsto para próxima administração do medicamento parenteral (por exemplo, heparina de baixo peso molecular) ou no momento da descontinuação da administração parenteral contínua do medicamento (por exemplo, heparina não fracionada intravenosa).
Convertendo de Rivaroxabana para anticoagulantes parenterais
Descontinue o uso de Rivaroxabana e administre a primeira dose do anticoagulante parenteral no momento em que a próxima dose de Rivaroxabana seria administrada.
Crianças e adolescentes (do nascimento aos 18 anos)
A segurança e eficácia não foram estabelecidas em crianças e adolescentes com idade inferior a 18 anos.
Pacientes idosos
Não é necessário ajuste de dose com base na idade do paciente.
Gênero
Não é necessário ajuste de dose com base no sexo do paciente.
Peso corporal
Não é necessário ajuste de dose baseado no peso corporal do paciente.
Diferenças étnicas
Não é necessário ajuste de dose com base em diferenças étnicas.
Quais as reações adversas e os efeitos colaterais do Rivaroxabana?
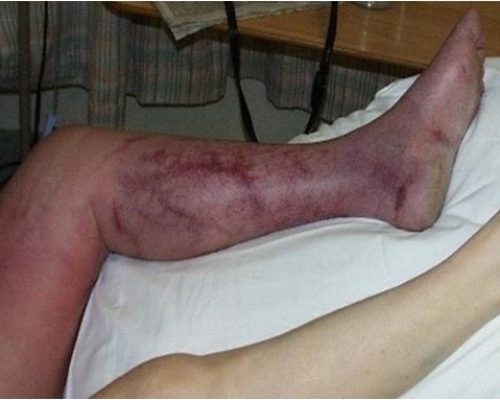
Em razão do modo de ação farmacológica, Rivaroxabana pode ser associado a um risco aumentado de sangramento oculto ou manifesto em qualquer tecido e órgão, o que pode resultar em anemia pós-hemorrágica. O risco de sangramentos pode ser aumentado em certos grupos de pacientes, por exemplo, naqueles com hipertensão arterial grave não-controlada e/ou com medicação concomitante que afete a hemostasia.
Os sinais, sintomas e gravidade (incluindo desfecho fatal) irão variar de acordo com a localização e o grau ou extensão do sangramento e/ou anemia.
Complicações hemorrágicas podem se apresentar como fraqueza, palidez, tontura, cefaleia ou edema inexplicável, dispneia e choque inexplicável. Em alguns casos, como consequência da anemia, foram observados sintomas de isquemia cardíaca, tais como dor no peito ou angina pectoris.
Foram relatadas para Rivaroxabana complicações conhecidas secundárias ao sangramento grave, como síndrome compartimental e insuficiência renal devido à hipoperfusão. Portanto, deve-se considerar a possibilidade de hemorragia ao avaliar a condição de qualquer paciente anticoaguladas.
As frequências das reações adversas ao medicamento relatadas com Rivaroxabana estão resumidas na tabela abaixo. As reações adversas estão apresentadas em ordem decrescente de gravidade, dentro de cada grupo de frequência.
As frequências estão definidas como:
Muito comum ( ≥ 1/10);
Comum ( ≥ 1/100 a < 1/10);
Incomum ( ≥ 1/1.000 a < 1/100);
Rara ( ≥ 1/10.000 a < 1/1.000).
Observações pós-comercialização
As seguintes reações adversas foram relatadas no período de pós-comercialização em associação temporal com o uso de Rivaroxabana. A frequência dessas reações adversas relatadas na experiência de pós-comercialização não pode ser estimada.
Distúrbios do sistema imunológico
Angioedema e edema alérgico (nos dados agrupados dos estudos Fase III, estes eventos foram incomuns (≥ 1/1.000 a < 1/100)).
Distúrbios hepatobiliares
Colestase, hepatite (incluindo lesão hepatocelular) (nos dados agrupados dos estudos Fase III, estes eventos foram raros (≥ 1/10.000 a < 1/1.000)).
Distúrbios do sistema sanguíneo e linfático
Trombocitopenia (nos dados agrupados dos estudos Fase III, estes eventos foram incomuns (≥ 1/1.000 a < 1/100)).
Atenção: este produto é um medicamento que possui nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos – Vigimes, disponível em http://portal.anvisa.gov.br/vigimed, ou para a Vigilância Sanitária Estadual ou Municipal.
Interação medicamentosa: quais os efeitos de tomar Rivaroxabana com outros remédios?
Comprimido 10mg / 15 mg / 20mg
Interações farmacocinéticas
A rivaroxabana é eliminada principalmente pelo metabolismo hepático mediado pelo citocromo P450 (CYP3A4, CYP2J2) e por excreção renal do fármaco inalterado, envolvendo sistemas de transportadores glicoproteína-P (gp-P)/proteína de resistência ao câncer de mama (Bcrp).
Inibição do CYP
A rivaroxabana não inibe a CYP3A4 nem qualquer outra isoforma principal de CYP.
Indução do CYP
A rivaroxabana não induz a CYP3A4 nem qualquer outra isoforma principal de CYP.
Efeitos na rivaroxabana
O uso concomitante de Rivaroxabana com inibidores potentes da CYP3A4 e inibidores da gp-P pode levar à redução da depuração hepática e renal e, deste modo, ao aumento significativo da exposição sistêmica.
A coadministração de Rivaroxabana com cetoconazol, antimicótico azólico (400 mg uma vez ao dia), um potente inibidor da CYP3A4 e da gp-P, levou a um aumento de 2,6 vezes da AUC média da rivaroxabana no estado de equilíbrio e um aumento de 1,7 vezes da Cmáx média da rivaroxabana, com elevações significativas de seus efeitos farmacodinâmicos.
A coadministração de Rivaroxabana com o inibidor da protease do HIV, ritonavir (600 mg duas vezes ao dia), um potente inibidor da CYP3A4 e da gp-P, levou a um aumento de 2,5 vezes da AUC média da rivaroxabana e a um aumento de 1,6 vezes de Cmáx média de rivaroxabana, com elevações significativas de seus efeitos farmacodinâmicos.
Portanto, Rivaroxabana não é recomendado em pacientes que estejam recebendo tratamento sistêmico concomitante com antimicóticos azólicos ou inibidores da protease do HIV.
Para outros fármacos que inibam potentemente apenas uma das vias de eliminação da rivaroxabana, seja CYP3A4 ou gp-P, é esperado que o aumento das concentrações plasmáticas de rivaroxabana seja de menor extensão.
A claritromicina (500 mg duas vezes ao dia), considerada um potente inibidor da CYP3A4 e inibidor moderado da gp-P, levou ao aumento de 1,5 vezes da AUC média da rivaroxabana e de 1,4 vezes da Cmáx. Este aumento, que está próximo da magnitude da variabilidade normal da AUC e Cmáx, é considerado clinicamente irrelevante.
A eritromicina (500 mg três vezes ao dia), que inibe moderadamente CYP3A4 e gp-P, levou a um aumento de 1,3 vezes da AUC e da Cmáx média da rivaroxabana. Este aumento está dentro da magnitude de variabilidade normal da AUC e Cmáx e é considerado clinicamente irrelevante.
Em indivíduos com insuficiência renal leve, eritromicina (500 mg três vezes ao dia) levou a um aumento de 1,8 vezes da AUC média de rivaroxabana e de 1,6 vezes da Cmáx quando comparado a indivíduos com função renal normal sem comedicação. Em indivíduos com insuficiência renal moderada, a eritromicina levou a um aumento de 2,0 vezes da AUC média de rivaroxabana e de 1,6 vezes da Cmáx quando comparado a indivíduos com função renal normal sem comedicação.
O fluconazol (400 mg uma vez ao dia), considerado um inibidor moderado da CYP3A4, levou a um aumento de 1,4 vezes da AUC média da rivaroxabana e 1,3 vezes da Cmáx média. Este aumento está dentro da magnitude da variabilidade normal de AUC e Cmáx e é considerado como clinicamente irrelevante.
A coadministração de Rivaroxabana com rifampicina, indutor potente da CYP3A4 e da gp-P, levou a uma diminuição aproximada de 50% da AUC média da rivaroxabana, com diminuições paralelas em seus efeitos farmacodinâmicos.
O uso concomitante de Rivaroxabana com outros indutores potentes da CYP3A4 (por exemplo, fenitoína, carbamazepina, fenobarbital ou Erva de São João) também pode levar a uma diminuição da concentração plasmática de rivaroxabana.
Exclusivo Comprimido 10mg
A diminuição das concentrações plasmáticas de rivaroxabana é considerada clinicamente irrelevante para pacientes tratados com 10 mg de Rivaroxabana uma vez ao dia para prevenção do TEV após artroplastia de quadril ou joelho.
Exclusivo Comprimido 15mg / 20mg
Em função de dados clínicos limitados disponíveis com dronedarona, a coadministração deve ser evitada.
Interações farmacodinâmicas
Após administração combinada de enoxaparina (40 mg em dose única) com Rivaroxabana (10 mg em dose única), foi observado um efeito aditivo sobre a atividade anti-fator Xa sem qualquer efeito adicional sobre os testes de coagulação (TP, TTPa). A enoxaparina não afetou a farmacocinética da rivaroxabana.
O clopidogrel (300 mg em dose de ataque, seguida por 75 mg de dose de manutenção) não mostrou interação farmacocinética (com Rivaroxabana 15 mg), mas foi observado um aumento relevante dos tempos de sangramento em um subgrupo de pacientes, e esse efeito não foi correlacionado à agregação plaquetária, à P-selectina ou aos níveis do receptor GPIIb/IIIa.
Não foi observado prolongamento clinicamente relevante do tempo de sangramento após administração concomitante de Rivaroxabana (15 mg) e 500 mg de naproxeno. Todavia, pode haver indivíduos com resposta farmacodinâmica mais pronunciada.
Ao converter pacientes de varfarina (RNI 2,0 a 3,0) para Rivaroxabana (20 mg) ou de Rivaroxabana (20 mg) para varfarina (RNI 2,0 a 3,0) houve um aumento do tempo de protrombina (TP)/ RNI (Neoplastin®) mais que aditivamente (podem ser observados valores individuais de RNI de até 12) enquanto os efeitos sobre o TTPa, a inibição da atividade do fator Xa e o potencial de trombina endógena foram aditivos.
Se for desejado testar os efeitos farmacodinâmicos de Rivaroxabana durante o período de conversão, a atividade anti-fator Xa, PiCT e HepTest® podem ser usados como testes, uma vez que estes testes não são afetados pela varfarina.
A partir do quarto dia da interrupção da varfarina, todos os testes (incluindo TP, TTPa, inibição da atividade do fator Xa e ETP) refletiram apenas o efeito de Rivaroxabana.
Se for desejado testar os efeitos farmacodinâmicos da varfarina durante o período de conversão, a avaliação da RNI pode ser utilizada na Cmin da rivaroxabana (24 horas após a ingestão anterior da rivaroxabana) uma vez que este teste é minimamente afetado pela rivaroxabana neste ponto de tempo.
Nenhuma interação farmacocinética foi observada entre varfarina e Rivaroxabana.
Tal como acontece com outros anticoagulantes, pode existir a possibilidade de pacientes apresentarem um risco aumentado de sangramento em caso de uso concomitante com ISRSs ou IRSNs devido ao seu efeito relatado sobre as plaquetas.
Quando usado concomitantemente no programa clínico de rivaroxabana, foram observadas taxas numericamente mais elevadas de sangramento importante ou não importante clinicamente relevante em todos os grupos de tratamento.
Interações cuja existência não foi demonstrada
Não houve interações farmacocinéticas mútuas entre rivaroxabana e midazolam (substrato de CYP3A4), digoxina (substrato de glicoproteína-P) ou atorvastatina (substrato de CYP3A4 e gp-P).
A coadministração do inibidor da bomba de prótons omeprazol, do antagonista do receptor H2 ranitidina, do antiácido hidróxido de alumínio/hidróxido de magnésio, naproxeno, clopidogrel ou enoxaparina não afetou a biodisponibilidade e a farmacocinética da rivaroxabana.
Não foram observadas interações farmacocinéticas ou farmacodinâmicas clinicamente significativas quando Rivaroxabana foi coadministrado com 500 mg de ácido acetilsalicílico.
Interações com parâmetros laboratoriais
Os testes de parâmetros da coagulação (TP, TTPa, HepTest®) são afetados como esperado pelo modo de ação de Rivaroxabana.
Exclusivo Comprimido 10mg
Interações com tabaco e álcool
Não foi realizado estudo formal sobre a interação com tabaco ou ácool, uma vez que interação farmacocinética não é prevista. Durante os estudos de fase I, não era permitido o consumo de álcool pelos pacientes.
Durante a fase ambulatorial, era permitido o consumo de álcool pelos pacientes em doses de até 40 g por dia. Era permitido fumar durante o ensaio.
Nos estudos de fase III (Record 1, 2 e 3) não houve restrição quanto ao consumo de tabaco. O abuso de álcool foi um critério de exclusão em todos os estudos de fase III, mas não foram utilizadas restrições adicionais nos ensaios.
Cerca de 50% dos 4657 pacientes no grupo da rivaroxabana submetidos à artroplastia de joelho ou quadril nos estudos de fase III relataram em seu histórico médico o consumo de álcool ao menos eventualmente. Pacientes foram ambulatoriais durante algum tempo, mas não há disponível nenhuma informação adicional sobre o uso concomitante de álcool e tabaco.
Quais cuidados devo ter ao usar o Rivaroxabana?
Comprimido 10mg
Risco de sangramento
Rivaroxabana, como outros antitrombóticos, deve ser utilizado com cautela em pacientes com risco aumentado de sangramento, tais como:
Distúrbios hemorrágicos adquiridos ou congênitos;
Hipertensão arterial grave não controlada;
Doença gastrintestinal ulcerativa ativa;
Ulcerações gastrintestinais recentes;
Retinopatia vascular;
Hemorragia intracraniana ou intracerebral recente;
Anormalidades vasculares intraespinais ou intracerebrais;
Cirurgia cerebral, espinhal ou oftalmológica recente;
Bronquiectasia ou história de sangramento pulmonar.
Deve-se ter cuidado se os pacientes forem tratados concomitantemente com fármacos que interferem na hemostasia, como os anti-inflamatórios não-esteroidais (AINEs), ácido acetilsalicílico, os inibidores da agregação plaquetária, outros antitrombóticos ou inibidores seletivos da recaptação de serotonina (ISRSs) e inibidores da recaptação de serotonina e noradrenalina (IRSNs).
Pode-se considerar tratamento profilático adequado para pacientes com risco de doença ulcerativa gastrintestinal.
Qualquer queda de hemoglobina ou da pressão arterial sem explicação deve levar à investigação de um local com sangramento.
Anestesia neuraxial (epidural/espinhal)
Quando anestesia neuraxial (epidural/espinhal) ou uma punção espinhal é realizada, os pacientes tratados com antitrombóticos para prevenção de complicações tromboembólicas correm o risco de desenvolver hematoma epidural ou espinhal que pode resultar em paralisia prolongada.
O risco destes eventos é ainda maior pelo uso de cateteres epidurais de demora ou pelo uso concomitante de medicamentos que afetem a hemostasia. O risco também pode aumentar por punção epidural ou espinhal traumática ou repetida.
Pacientes devem ser frequentemente monitorados para sinais e sintomas de alteração neurológica (por exemplo, torpor ou fraqueza das pernas, disfunção intestinal ou da bexiga). Se forem observados déficits neurológicos, serão necessários diagnóstico e tratamento urgentes.
O médico deve considerar o benefício em potencial em relação ao risco antes da intervenção neuraxial em pacientes anticoagulados ou que vão ser anticoagulados para tromboprofilaxia.
Para reduzir o risco potencial de sangramento associado ao uso concomitante de rivaroxabana e anestesia neuraxial (epidural/espinhal) ou punção espinhal, considerar o perfil farmacocinético de rivaroxabana. A inserção ou remoção de um cateter epidural ou punção lombar é melhor realizada quando o efeito anticoagulante de rivaroxabana é estimado ser baixo.
Um cateter epidural não deve ser removido antes de 18 horas após a última administração de Rivaroxabana.
Rivaroxabana deve ser administrado, pelo menos, 6 horas após a remoção do cateter.
Se ocorrer punção traumática, a administração de Rivaroxabana deverá ser adiada por 24 horas.
Cirurgia e intervenções
Se um procedimento invasivo ou uma intervenção cirúrgica forem necessários, Rivaroxabana 10 mg deve ser interrompido pelo menos 24 horas antes da intervenção, se possível, e com base no julgamento clínico do médico.
Se o procedimento não puder ser adiado, o aumento do risco de sangramento deve ser avaliado em relação à urgência de tal intervenção.
A administração de Rivaroxabana deve ser reiniciada o mais rapidamente possível após o procedimento invasivo ou a intervenção cirúrgica, desde que a situação clínica do paciente permita e a hemostasia adequada tenha sido estabelecida.
Pacientes com próteses valvulares cardíacas
Rivaroxabana não é recomendadopara tromboprofilaxia em pacientes que foram recentemente submetidos a substituição da válvula aórtica transcateter (TAVR), baseado nos dados de um estudo clínico randomizado, controlado comparando um regime de Rivaroxabana a um regime de antiagregante plaquetário.
A segurança e a eficácia de Rivaroxabana não foram estudadas em pacientes com outras próteses de válvulas cardíacas ou outros procedimentos valvulares; portanto, não há dados para suportar que Rivaroxabana forneça anticoagulação adequada nestas populações de pacientes.
Pacientes com síndrome antifosfolípide triplo positivo de alto risco
Rivaroxabana não é recomendado em pacientes com antecedentes de trombose diagnosticados com síndrome antifosfolípide e com persistência tripla positiva (para anticoagulante lúpico, anticorpos anticardiolipina e anticorpos antibeta 2-glicoproteína I), uma vez que o tratamento com rivaroxabana está associado a um aumento da taxa de eventos trombóticos recorrentes comparados com antagonistas da vitamina K (AVK).
Insuficiência renal
Rivaroxabana deve ser utilizado com cautela em pacientes com insuficiência renal moderada (ClCr < 50-30 mL/min) que estejam recebendo comedicações que levam ao aumento da concentração de rivaroxabana no plasma.
Em pacientes com insuficiência renal grave (ClCr < 30 mL/min), os níveis plasmáticos de rivaroxabana podem elevar-se significativamente (1,6 vezes em média), o que pode levar a um aumento do risco de sangramento. Em razão da doença de base, estes pacientes têm um aumento do risco de sangramento e de trombose. Em virtude dos dados clínicos limitados, Rivaroxabana deve ser usado com cautela nos pacientes com ClCr < 30-15 mL/min.
Não há dados clínicos disponíveis para pacientes com insuficiência renal grave (ClCr < 15 mL/min). Portanto o uso de Rivaroxabana não é recomendado nestes pacientes.
Após início do tratamento, os pacientes com insuficiência renal grave ou risco aumentado de sangramentos e aqueles que recebem tratamento sistêmico concomitante com antimicóticos azólicos ou inibidores das proteases do HIV devem ser cuidadosamente monitorados quanto a sinais de complicações hemorrágicas. Isto pode ser feito por exame físico regular dos pacientes, observação atenta da drenagem da incisão cirúrgica e dosagens periódicas da hemoglobina.
Medicação concomitante
Rivaroxabana não é recomendado em pacientes recebendo tratamento sistêmico concomitante com antimicóticos azólicos (por exemplo, cetoconazol) ou inibidores da protease do HIV (por exemplo, ritonavir). Estes fármacos são potentes inibidores da CYP3A4 e da gp-P. Portanto, estes fármacos podem aumentar as concentrações plasmáticas de rivaroxabana até um grau clinicamente relevante (2,6 vezes em média), o que pode levar ao aumento no risco de sangramentos.
O antimicótico azólico fluconazol, um inibidor moderado da CYP3A4, tem entretanto, menos efeito sobre a exposição à rivaroxabana e pode ser coadministrado.
Prolongamento do QTc
Não foi observado efeito de prolongamento do QTc com o uso de Rivaroxabana.
Informação sobre os excipientes
Como este medicamento contém lactose, os pacientes com problemas hereditários raros de intolerância à lactose ou à galactose (por exemplo, deficiência de lactase de Lapp ou má absorção de glicose-galactose) não devem tomar Rivaroxabana.
Tratamento e prevenção de TVP e EP recorrentes: pacientes com embolia pulmonar hemodinamicamente instáveis ou pacientes que necessitam de trombólise ou embolectomia pulmonar
Rivaroxabana não é recomendado como uma alternativa à heparina não fracionada em pacientes com embolia pulmonar que estejam hemodinamicamente instáveis ou que possam receber trombólise ou embolectomia pulmonar, uma vez que a segurança e eficácia de Rivaroxabana não foram estabelecidas nestas situações clínicas.
Gravidez
A segurança e eficácia de Rivaroxabana não foram estabelecidas em mulheres grávidas.
Em ratas e coelhas, a rivaroxabana mostrou pronunciada toxicidade materna, com alterações placentárias relacionadas ao seu modo de ação farmacológico (por exemplo, complicações hemorrágicas) levando à toxicidade reprodutiva. Não se identificou potencial teratogênico primário.
Devido ao risco intrínseco de sangramentos e à evidência de que a rivaroxabana atravessa a placenta, o uso de Rivaroxabana é contraindicado na gravidez.
Lactação
Não foram estabelecidas segurança e eficácia de Rivaroxabana em lactantes. Em ratas, a rivaroxabana é secretada no leite materno. Portanto, Rivaroxabana só pode ser administrado depois de descontinuada a amamentação.
Mulheres em idade fértil/Contracepção
Rivaroxabana deve ser utilizado em mulheres em idade fértil somente com um método contraceptivo eficaz.
Efeitos sobre a capacidade de dirigir veículos ou operar máquinas
Foram relatadas síncopes e tonturas, o que podem afetar a habilidade de dirigir veículos ou operar máquinas. Pacientes que apresentarem estas reações adversas não devem dirigir ou operar máquinas.
Comprimido 15mg / 20mg
Pacientes com próteses valvulares cardíacas
Rivaroxabana não é recomendado para tromboprofilaxia em pacientes que foram recentemente submetidos a substituição da válvula aórtica transcateter (TAVR), baseado nos dados de um estudo clínico randomizado, controlado comparando um regime de Rivaroxabana a um regime de antiagregante plaquetário.
A segurança e eficácia de Rivaroxabana não foram estudadas em pacientes com outras próteses de válvulas cardíacas ou outros procedimentos valvulares; portanto, não há dados para suportar que Rivaroxabana forneça anticoagulação adequada nestas populações de pacientes.
Pacientes com síndrome antifosfolípide triplo positivo de alto risco
Rivaroxabana não é recomendado em pacientes com antecedentes de trombose diagnosticados com síndrome antifosfolípide e com persistência tripla positiva (para anticoagulante lúpico, anticorpos anticardiolipina e anticorpos antibeta 2-glicoproteína I), uma vez que o tratamento com rivaroxabana está associado a um aumento da taxa de eventos trombóticos recorrentes comparados com antagonistas da vitamina K (AVK).
Medicação concomitante
Rivaroxabana não é recomendado em pacientes recebendo tratamento sistêmico concomitante com antimicóticos azólicos (por exemplo, cetoconazol) ou inibidores das proteases do HIV (por exemplo, ritonavir). Estes fármacos são potentes inibidores da CYP3A4 e da gp-P. Portanto, estes fármacos podem aumentar as concentrações plasmáticas da rivaroxabana até um grau clinicamente relevante (2,6 vezes em média), o que pode levar ao aumento do risco de sangramentos.
Entretanto, o antimicótico azólico fluconazol, um inibidor moderado da CYP3A4, tem menor efeito na exposição à rivaroxabana e pode ser coadministrado.
Tratamento e prevenção de TVP e EP recorrentes: Insuficiência renal
Rivaroxabana deve ser utilizado com cautela em pacientes com insuficiência renal que estejam recebendo comedicações que levem ao aumento da concentração de rivaroxabana no plasma.
Prevenção de acidente vascular cerebral e embolia sistêmica em pacientes com fibrilação atrial não-valvular, tratamento e prevenção de TVP e EP recorrentes: Insuficiência renal
Em pacientes com insuficiência renal grave (ClCr < 30 mL/min), os níveis plasmáticos de rivaroxabana podem elevar-se significativamente (1,6 vezes na média), o que pode levar a um aumento do risco de sangramento. Em razão da doença de base, estes pacientes têm um aumento do risco de sangramento e de trombose.
Em virtude dos dados clínicos limitados, Rivaroxabana deve ser utilizado com cautela nos pacientes com ClCr < 30-15 mL/min.
Não há dados clínicos disponíveis para pacientes com insuficiência renal grave (ClCr < 15 mL/min). Portanto, o uso de Rivaroxabana não é recomendado nestes pacientes.
Após o início do tratamento, os pacientes com insuficiência renal grave ou risco aumentado de sangramentos e aqueles que recebem tratamento sistêmico concomitante com antimicóticos azólicos ou inibidores das proteases do HIV devem ser cuidadosamente monitorados quanto a sinais de complicações hemorrágicas.
Risco de sangramento
Rivaroxabana, como outros antitrombóticos, deve ser utilizado com cautela em pacientes com risco aumentado de sangramento, tais como:
Distúrbios hemorrágicos adquiridos ou congênitos;
Hipertensão arterial grave não controlada;
Doença gastrintestinal ulcerativa ativa;
Ulcerações gastrintestinais recentes;
Retinopatia vascular;
Hemorragia intracraniana ou intracerebral recente;
Anormalidades vasculares intraespinais ou intracerebrais;
Cirurgia cerebral, espinhal ou oftalmológica recente;
Bronquiectasia ou história de sangramento pulmonar.
Deve-se ter cuidado se os pacientes forem tratados concomitantemente com fármacos que interferem na hemostasia, como os anti-inflamatórios não-esteroidais (AINEs), ácido acetilsalicílico, os inibidores da agregação plaquetária, outros antitrombóticos ou inibidores seletivos da recaptação de serotonina (ISRSs) e inibidores da recaptação de serotonina e noradrenalina (IRSNs).
Pode-se considerar tratamento profilático adequado para pacientes com risco de doença ulcerativa gastrintestinal.
Qualquer queda de hemoglobina ou da pressão arterial sem explicação deve levar à investigação de um local com sangramento.
Cirurgia e intervenções
Se um procedimento invasivo ou uma intervenção cirúrgica forem necessários, Rivaroxabana deve ser interrompido pelo menos 24 horas antes da intervenção, se possível, e com base no julgamento clínico do médico.
Se o procedimento não puder ser adiado, o aumento do risco de sangramento deve ser avaliado em relação à urgência de tal intervenção.
A administração de Rivaroxabana deve ser reiniciada o mais rapidamente possível após o procedimento invasivo ou a intervenção cirúrgica, desde que a situação clínica do paciente permita e a hemostasia adequada tenha sido estabelecida.
Anestesia neuraxial (epidural/espinhal)
Quando anestesia neuraxial (epidural/espinhal) ou uma punção espinhal é realizada, os pacientes tratados com antitrombóticos para prevenção de complicações tromboembólicas correm o risco de desenvolver hematoma epidural ou espinhal que pode resultar em paralisia prolongada.
O risco destes eventos é ainda maior pelo uso de cateteres epidurais de demora ou pelo uso concomitante de medicamentos que afetem a hemostasia. O risco também pode aumentar por punção epidural ou espinhal traumática ou repetida.
Pacientes devem ser frequentemente monitorados para sinais e sintomas de alteração neurológica (por exemplo, dormência ou fraqueza das pernas, disfunção intestinal ou da bexiga). Se forem observados déficits neurológicos, serão necessários diagnóstico e tratamento urgentes.
O médico deve considerar o benefício potencial em relação ao risco antes da intervenção neuraxial em pacientes anticoagulados ou que vão ser anticoagulados para tromboprofilaxia.
Não há experiência clínica com o uso de rivaroxabana 15 mg e 20 mg nestas situações. Para reduzir o risco potencial de sangramento associado ao uso concomitante de rivaroxabana e anestesia neuraxial (epidural/espinhal) ou punção espinhal, deve ser considerado o perfil farmacocinético de rivaroxabana. A inserção ou remoção de um cateter epidural ou punção lombar é melhor realizada quando o efeito anticoagulante de rivaroxabana é estimado ser baixo. No entanto, não é conhecido o momento exato para atingir um efeito anticoagulante considerado suficientemente baixo em cada paciente.
Para a remoção de um cateter epidural, e com base nas características farmacocinéticas gerais, deve-se esperar o tempo de pelo menos 2x a meia-vida do medicamento, ou seja, pelo menos 18 horas para pacientes jovens e 26 horas para pacientes idosos, após a última administração de Rivaroxabana.
Rivaroxabana deve ser administrado, pelo menos, 6 horas após a remoção do cateter.
Se ocorrer punção traumática, a administração de Rivaroxabana deverá ser adiada por 24 horas.
Prolongamento do QTc
Não foi observado efeito de prolongamento do QTc com o uso de Rivaroxabana.
Informação sobre os excipientes
Como este medicamento contém lactose, os pacientes com problemas hereditários raros de intolerância à lactose ou à galactose (por exemplo, deficiência de lactase de Lapp ou má absorção de glicose-galactose) não devem tomar Rivaroxabana.
Tratamento e prevenção de TVP e EP recorrentes: pacientes com embolia pulmonar hemodinamicamente instáveis ou pacientes que necessitam de trombólise ou embolectomia pulmonar
Rivaroxabana não é recomendado como uma alternativa à heparina não fracionada em pacientes com embolia pulmonar que estejam hemodinamicamente instáveis ou que possam receber trombólise ou embolectomia pulmonar, uma vez que a segurança e eficácia de Rivaroxabana não foram estabelecidas nestas situações clínicas.
Prevenção de acidente vascular cerebral e embolia sistêmica em pacientes com fibrilação atrial não-valvular: Pacientes submetidos a Intervenção Coronária Percutânea (ICP) com colocação de stent
Os dados clínicos disponíveis foram gerados a partir de um estudo intervencionista com o objetivo primário de avaliar a segurança em pacientes com fibrilação atrial não-valvular submetidos à ICP com colocação de stent. Os dados sobre a eficácia nesta população são limitados.
Gravidez
A segurança e eficácia de Rivaroxabana não foram estabelecidas em mulheres grávidas.
Em ratas e coelhas, a rivaroxabana mostrou pronunciada toxicidade materna, com alterações placentárias relacionadas ao seu modo de ação farmacológico (por exemplo, complicações hemorrágicas) levando à toxicidade reprodutiva. Não se identificou potencial teratogênico primário. Devido ao risco intrínseco de sangramentos e à evidência de que a rivaroxabana atravessa a placenta, o uso de Rivaroxabana é contraindicado na gravidez.
Lactação
Não foram estabelecidas segurança e eficácia de Rivaroxabana em lactantes. Em ratas, a rivaroxabana é secretada no leite materno. Portanto, Rivaroxabana só pode ser administrado depois de descontinuada a amamentação.
Mulheres em idade fértil/Contracepção
Rivaroxabana deve ser utilizado em mulheres em idade fértil somente com um método contraceptivo eficaz.
Efeitos sobre a capacidade de dirigir veículos ou operar máquinas
Foram relatadas síncopes e tonturas, o que podem afetar a habilidade de dirigir veículos e operar máquinas. Pacientes que apresentarem estas reações adversas não devem dirigir ou operar máquinas.
Qual a ação da substância Rivaroxabana?
Resultados de Eficácia
Comprimido 10mg / 15mg / 20mg
Tratamento de trombose venosa profunda (TVP) e embolia pulmonar (EP) e prevenção de TVP e EP recorrentes
O programa clínico de Rivaroxabana foi desenhado para demonstrar a eficácia do medicamento no tratamento inicial e continuado de trombose venosa profunda (TVP) aguda e embolia pulmonar (EP) e na prevenção de TVP e de EP recorrentes.
Mais de 12.800 pacientes foram estudados em quatro estudos clínicos de fase III, randomizados, controlados (Einstein TVP, Einstein EP, Einstein Extension e Einstein Choice) e adicionalmente foi realizada uma análise combinada predefinida dos estudos Einstein TVP e Einstein EP (veja Tabela 4: Resultados de eficácia e segurança dos estudos de fase III Einstein TVP e EINTEIN EP). A duração total do tratamento combinado em todos os estudos foi de até 21 meses.
No estudo Einstein TVP, 3.449 pacientes com TVP aguda foram estudados para o tratamento de TVP e prevenção de TVP e de EP recorrentes. A duração do tratamento foi de até 12 meses dependendo do julgamento clínico do investigador.
Para as três semanas iniciais de tratamento da TVP aguda, uma dose de 15 mg de Rivaroxabana foi administrada duas vezes ao dia. Isto foi seguido por uma dose de 20 mg de Rivaroxabana uma vez ao dia.
No estudo Einstein EP, 4.832 pacientes com EP aguda foram estudados para o tratamento de EP e prevenção de TVP e EP recorrentes. A duração do tratamento foi de até 12 meses dependendo do julgamento clínico do investigador.
Para o tratamento inicial de EP aguda, uma dose de 15 mg de rivaroxabana foi administrada duas vezes ao dia por três semanas. Isso foi seguido por uma dose de 20 mg de rivaroxabana uma vez ao dia.
Em ambos os estudos Einstein TVP e Einstein EP, o regime de tratamento comparador consistiu em administrar enoxaparina por pelo menos cinco dias em combinação com antagonista da vitamina K até que o valor de TP/RNI atingisse a faixa terapêutica (> 2,0). O tratamento foi continuado com o antagonista da vitamina K com dose ajustada para manter os valores de TP/RNI dentro da faixa terapêutica de 2,0 a 3,0.
No estudo Einstein Extension, 1.197 pacientes com TVP ou EP foram estudados para a prevenção de TVP e de EP recorrentes. A duração do tratamento foi de até 12 meses, dependendo do julgamento clínico do investigador. Rivaroxabana 20 mg uma vez ao dia foi comparado com placebo.
Os estudos Einstein TVP, EP e Extension usaram os mesmos desfechos primário e secundário de eficácia predefinidos. O desfecho primário de eficácia foi TEV recorrente sintomático, definido como o composto de TVP recorrente ou EP fatal ou não fatal. O desfecho secundário de eficácia foi definido como o composto de TVP recorrente, EP não fatal e mortalidade por todas as causas.
No estudo Einstein Choice, 3.396 pacientes com TVP e/ou EP sintomática confirmada que completaram 6-12 meses de tratamento anticoagulante foram estudados para a prevenção de EP fatal ou TVP ou EP recorrente sintomática não fatal. Os pacientes com indicação de anticoagulação com dose terapêutica continuada foram excluídos do estudo. A duração do tratamento foi de até 12 meses dependendo da data de randomização individual (mediana: 351 dias). Rivaroxabana 20 mg uma vez ao dia e Rivaroxabana 10 mg uma vez ao dia foram comparados com 100 mg de ácido acetilsalicílico uma vez ao dia.
O desfecho primário de eficácia foi a TEV recorrente sintomático, definido como o composto de TVP recorrente ou EP fatal ou não fatal. O desfecho secundário de eficácia foi o composto do desfecho primário de eficácia, infarto do miocárdio, acidente vascular cerebral isquêmico ou embolia sistêmica não sistema nervoso central.
No estudo Einstein TVP (veja Tabela 2: Resultados de eficácia e segurança do estudo de fase III Einstein TVP), Rivaroxabana demonstrou ser não inferior à enoxaparina/AVK para o desfecho primário.
O benefício clínico líquido (NCB – Net Clinical Benefit) pré-especificado (desfecho primário de eficácia e eventos de sangramento importante) foi reportado com HR de 0,67 ((IC 95% = 0,47 – 0,95), valor nominal p = 0,027) a favor da rivaroxabana.
As taxas de incidência para o desfecho principal de segurança (eventos de sangramento importante ou não importante clinicamente relevante) assim como o desfecho secundário de segurança (eventos de sangramento importante), foram semelhantes para ambos os grupos de tratamento.
No estudo Einstein EP (veja Tabela 3: Resultados de eficácia e segurança do estudo de fase III Einstein EP) Rivaroxabana demonstrou ser não inferior à enoxaparina/AVK para o desfecho primário (p= 0,0026 (teste para nãoinferioridade); hazard ratio: 1,12 (0,75 – 1,68)).
O benefício clínico global pré-especificado (desfecho primário de eficácia e eventos de sangramento importante) foi reportado com um HR de 0,85 ((IC 95% = 0,63 – 1,14), valor nominal p= 0,275)).
Foi conduzida uma análise agrupada pré-especificada do resultado dos estudos Einstein TVP e Einstein EP (veja Tabela 4: Resultados de eficácia e segurança dos estudos de fase III Einstein TVP e EINTEIN EP).
No estudo Einstein Extension (veja Tabela 5: Resultados de eficácia e segurança do estudo de fase III Einstein Extension), Rivaroxabana foi superior ao placebo para os desfechos primário e secundário de eficácia. Para o desfecho principal de segurança (eventos de sangramento importante) houve uma taxa de incidência mais alta, numericamente não significativa, para pacientes tratados com Rivaroxabana 20 mg uma vez ao dia comparado com placebo. O desfecho de segurança secundário (eventos de sangramento importante ou não importante clinicamente relevante) demonstrou taxas mais altas para pacientes tratados com Rivaroxabana 20 mg uma vez ao dia comparado com placebo.
No estudo Einstein Choice, Rivaroxabana 20 mg e 10 mg foram ambos superiores a 100 mg de ácido acetilsalicílico para o desfecho primário de eficácia. O desfecho secundário de eficácia foi significativamente reduzido quando comparado com Rivaroxabana 20 mg ou 10 mg vs. 100 mg ácido acetilsalicílico. O desfecho principal de segurança (eventos de sangramento importantes) foi semelhante nos pacientes tratados com Rivaroxabana 20 mg e 10 mg 1x/dia, em comparação com 100 mg de ácido acetilsalicílico. O desfecho secundário de segurança (sangramento não importante associado à interupção do tratamento por mais de 14 dias) foi semelhante quando comparado Rivaroxabana 20 mg ou 10 mg vs. 100 mg de ácido acetilsalicílico.
Os resultados foram consistentes entre os pacientes com TEV provocado e não provocado (ver Tabela 6: Resultados de eficácia e segurança do estudo de fase III Einstein Choice). Em uma análise pré-especificada do benefício clínico líquido (NCB – Net Clinical Benefit) (desfecho primário de eficácia mais eventos de sangramento importantes) do Einstein Choice, foram relatados uma HR de 0,44 (IC 95% 0,27 – 0,71; p = 0,0009) para Rivaroxabana 20 mg 1x/dia vs. 100 mg de ácido acetilsalicílico 1x/dia e uma HR de 0,32 (IC 95% 0,18 – 0,55; p <0,0001) para Rivaroxabana 10 mg 1x/dia vs. 100 mg de ácido acetilsalicílico 1x/dia.
Além do programa Einstein de fase III, foi realizado um estudo de coorte aberto, prospectivo, não intervencionista (XALIA) com adjudicação central de desfecho, incluindo TEV recorrente, sangramento importante e morte. Foram incluídos 5.142 pacientes com TVP aguda para investigar a segurança a longo prazo de rivaroxabana em comparação com a terapia de anticoagulação padrão em condições de mundo real. As taxas de sangramento importante, TEV recorrente e mortalidade por todas as causas de rivaroxabana foram de 0,7%, 1,4% e 0,5%, respectivamente. Foram ajustados os “hazard ratios” comparando rivaroxabana e padrão de cuidados para levar em conta as diferenças nas características basais do paciente. Os “hazard ratios” ajustados para sangramento importante, TEV recorrente e mortalidade por todas as causas foram 0,77 (IC 95% 0,40-1,50), 0,91 (IC 95% 0,54-1,54) e 0,51 (IC 95% 0,24-1,07), respectivamente.
A rivaroxabana mostrou segurança e eficácia semelhantes em comparação com a anticoagulação padrão. Estes resultados em pacientes que foram observados na prática clínica de rotina são consistentes com aqueles observados no estudo Einstein TVP.
Exclusivo Comprimido 10mg
Prevenção de eventos tromboembólicos venosos (TEV)
Prevenção de eventos tromboembólicos venosos (TEV) em pacientes submetidos à cirurgia ortopédica de grande porte dos membros inferiores.
O programa clínico da rivaroxabana foi elaborado para demonstrar a eficácia de Rivaroxabana para a prevenção de eventos tromboembólicos venosos (TEV), por exemplo, trombose venosa profunda (TVP) proximal e distal e embolia pulmonar (EP) em pacientes submetidos à cirurgia ortopédica de grande porte dos membros inferiores. Mais de 9.500 pacientes (7.050 em cirurgia de artroplastia total do quadril e 2.531 em cirurgia de artroplastia total do joelho) foram estudados em estudos clínicos de fase III controlados, duplo-cegos, randomizados, o programa Record.
Rivaroxabana, em dose de 10 mg uma vez ao dia, iniciada no mínimo 6 horas após a cirurgia, foi comparada a 40 mg de enoxaparina uma vez ao dia, iniciada em 12 horas antes da cirurgia.
Em três estudos de fase III (ver Tabela 1), a rivaroxabana reduziu significativamente a taxa de TEV total (qualquer TVP venograficamente detectada ou sintomática, EP não-fatal ou morte) e de TEV maior (TVP proximal, EP não-fatal e morte relacionada ao TEV), os desfechos finais (“endpoints”) de eficácia primária e secundária maior pré-especificados.
Além disso, em todos os três estudos, a taxa de TEV sintomático (TVP sintomática, EP não-fatal, morte relacionada a um TEV) foi menor nos pacientes tratados com Rivaroxabana, em comparação aos pacientes tratados com enoxaparina.
O objetivo final principal de segurança, sangramento importante, mostrou taxas comparáveis para pacientes tratados com 10 mg de Rivaroxabana, em comparação a 40 mg de enoxaparina.
Exclusivo Comprimido 15mg / 20mg
Prevenção de acidente vascular cerebral e embolia sistêmica em pacientes com fibrilação atrial não-valvular
O programa clínico de Rivaroxabana foi desenhado para demonstrar a eficácia de Rivaroxabana na prevenção de AVC e embolia sistêmica em pacientes com fibrilação atrial não-valvular (FA).
No estudo pivotal duplo-cego Rocket AF, 14.264 pacientes receberam 20 mg de Rivaroxabana via oral uma vez ao dia (15 mg via oral uma vez ao dia em pacientes com insuficiência renal moderada (ClCr: <50-30 mL/min)) ou varfarina titulada tendo como alvo RNI de 2,5 (faixa terapêutica 2,0 a 3,0). O tempo mediano do tratamento foi 19 meses e a duração total do tratamento foi de até 41 meses.
34,9% dos pacientes estavam usando ácido acetilsalicílico e 11,4% antiarrítmicos classe III incluindo amiodarona.
Em relação à varfarina, Rivaroxabana reduziu significativamente o desfecho primário combinado de AVC e embolia sistêmica fora do SNC. Adicionalmente, desfechos secundários importantes (combinação de acidente vascular cerebral, embolia sistêmica fora do SNC e morte vascular e a combinação de AVC, embolia sistêmica fora do SNC, infarto do miocárdio e morte vascular) também foram reduzidos de forma significativa (veja Tabela 1: Resultados de eficácia dos estudos de fase III Rocket AF). As taxas de incidência para o desfecho de segurança principal (eventos de sangramento importante e não importante clinicamente relevante) foram semelhantes nos dois grupos de tratamentoPacientes submetidos a Intervenção Coronária Percutânea (ICP) com colocação de stent
Um estudo randomizado, aberto, multicêntrico (PIONEER AF-PCI) foi realizado em 2.124 pacientes com fibrilação atrial não-valvular submetidos à ICP com colocação de stent para doença aterosclerótica primária para comparar a segurança de dois regimes de rivaroxabana e um regime de antagonista da vitamina K (AVK). Os pacientes foram randomizados na proporção de 1: 1: 1 para uma terapia total de 12 meses.
O grupo 1 recebeu rivaroxabana 15 mg uma vez ao dia (10 mg uma vez ao dia em pacientes com ClCr: 30 a <50 ml / min) mais inibidor de P2Y12 (antiplaquetário). O grupo 2 recebeu rivaroxabana 2,5 mg duas vezes ao dia mais DAPT (terapia antiplaquetária dupla, clopidogrel 75 mg [ou inibidor P2Y12 alternativo] mais ácido acetilsalicílico em baixa dose [AAS]) durante 1, 6 ou 12 meses seguido de rivaroxabana 15 mg (ou 10 mg para indivíduos com ClCr: 30 a <50 mL / min) uma vez ao dia mais baixas doses de AAS. O grupo 3 recebeu AVK em dose-ajustada mais DAPT durante 1, 6 ou 12 meses seguido por AVK em dose-ajustada mais AAS em baixa dose.
O desfecho primário de segurança, eventos de sangramento clinicamente significativos, ocorreram em 109 (15,7%), 117 (16,6%) e 167 (24,0%) pacientes no grupo 1, grupo 2 e grupo 3, respectivamente (HR 0,59; IC 95% 0,47-0,76; p <0,001 e HR 0,63; IC 95% 0,50- 0,80; p <0,001; respectivamente). O desfecho secundário (composto de eventos cardiovasculares, morte cardiovascular (CV) , infarto do miócardio (IM) ou AVC) ocorreu em 41 (5,9%), 36 (5,1%) e 36 (5,2%) indivíduos no grupo 1, grupo 2 e grupo 3, respectivamente. Cada um dos regimes de rivaroxabana mostrou uma redução significativa nos eventos de sangramento clinicamente significativo em comparação com o regime AVK em pacientes com fibrilação atrial não-valvular que foram submetidos a uma ICP com colocação de stent.
Características Farmacológicas
Comprimido 10mg / 15mg / 20mg
Propriedades farmacodinâmicas
Mecanismo de ação
A rivaroxabana é um inibidor direto altamente seletivo do fator Xa com biodisponibilidade oral.
A ativação do fator X a fator Xa (FXa) por meio das vias intrínseca e extrínseca desempenha um papel central na cascata da coagulação sanguínea. O FXa converte diretamente a protrombina em trombina por meio do complexo de protrombinase e, finalmente, esta reação leva à formação do coágulo de fibrina e à ativação das plaquetas pela trombina. Uma molécula de FXa é capaz de gerar mais de 1.000 moléculas de trombina devido à natureza amplificadora da cascata da coagulação. Além disso, a taxa de reação do FXa ligado à protrombinase aumenta 300.000 vezes, em comparação à do FXa livre, e causa uma descarga explosiva de geração de trombina. Os inibidores seletivos de FXa podem encerrar a descarga amplificada de geração de trombina. Consequentemente, diversos testes de coagulação específicos e globais são afetados pela rivaroxabana.
Efeitos farmacodinâmicos
Foi observada inibição dose-dependente da atividade do fator Xa em humanos.
O tempo de protrombina (TP) é influenciado pela rivaroxabana de um modo dosedependente com uma correlação estreita com as concentrações plasmáticas (o valor de r é igual a 0,98) se for usado o reagente Neoplastin® (tromboplastina liofilizada obtida a partir de cérebro de coelho) para a realização deste ensaio.
Outros reagentes proporcionariam resultados diferentes. A leitura do TP deve ser feita em segundos porque a RNI (Razão Normalizada Internacional) é calibrada e validada somente para cumarínicos e não pode ser usada para qualquer outro anticoagulante.
Em pacientes submetidos a cirurgia ortopédica de grande porte, os percentis 5/95 para TP (Neoplastin®) 2-4 horas depois da ingestão do comprimido (por exemplo, no momento de efeito máximo) variaram de 13 a 25 segundos para 10mg, 17 a 32 segundos para 15 mg duas vezes ao dia ou de 15 a 30 segundos para 20 mg uma vez ao dia, respectivamente.
O tempo de tromboplastina parcial ativada (TTPa) e o HepTest® também se prolongam dependendo da dose; entretanto, não são recomendados para avaliar o efeito farmacodinâmico da rivaroxabana. A atividade anti-fator Xa também é influenciada pela rivaroxabana; todavia, não existe padrão para calibração.
Não há necessidade de monitorar os parâmetros de coagulação durante o tratamento clínico de rotina com Rivaroxabana.
Exclusivo Comprimido 15mg / 20mg
Em pacientes com fibrilação atrial não-valvular recebendo rivaroxabana para a prevenção de AVC e embolia sistêmica, os percentis 5/95 para o TP (Neoplastin®) 1-4 horas após a ingestão do comprimido (ou seja, no momento de efeito máximo) variaram de 14 a 40 segundos em pacientes tratados com 20 mg uma vez ao dia e de 10 a 50 segundos em pacientes com insuficiência renal moderada tratados com 15 mg uma vez ao dia.
Populações especiais de pacientes
Pacientes com próteses valvulares cardíacas submetidos recentemente a TAVR
No estudo randomizado, aberto, controlado por ativo, orientado por evento, multicêntrico de Fase III Galileo, 1644 pacientes foram randomizados, tanto para uma estratégia baseada em rivaroxabana quanto para uma estratégia baseada em antiagregante plaquetário, de 1 a 7 dias após uma sucedida substituição da válvula aórtica transcateter. Pacientes com fibrilação atrial prévia ou com indicação para anticoagulantes orais em curso foram excluídos.
O principal objetivo foi avaliar a eficácia e a segurança da estratégia de tratamento baseada em rivaroxabana (10 mg de rivaroxabana, uma vez ao dia, mais 75-100 mg de ácido acetilsalicílico (AAS), uma vez ao dia, por 90 dias seguido por rivaroxabana 10 mg uma vez ao dia) comparado ao tratamento padrão (75 mg de clopidogrel uma vez ao dia mais 75-100 mg de ácido acetilsalicílico, uma vez ao dia, por 90 dias seguido por ácido acetilsalicílico, uma vez ao dia). O estudo foi encerrado precocemente devido a um desequilíbrio em eventos tromboembólicos e óbito.
Na análise de intenção de tratar (ITT), o desfecho primário de eficácia, por exemplo eventos tromboembólicos e óbito, ocorreu em 105 pacientes (9,8 por 100 pacientes-ano) no braço rivaroxabana e em 78 pacientes (7,21 por 100 pacientes-ano) no braço de antiagregante plaquetário. A razão de risco (HR) foi de 1,35 (IC 95%: 1,01; 1,81). Na análise durante o tratamento, o desfecho primário de eficácia ocorreu em 68 pacientes (8,11 por 100 pacientes-ano) no braço rivaroxabana comparado com 63 pacientes (6,6 por 100 pacientes-ano) no braço de antiagregante plaquetário; a razão de risco (HR) foi 1,21 (IC 95%: 0,86; 1,70).
Na análise de intenção de tratar (ITT), o desfecho primário de segurança, por exemplo composto de risco de vida, incapacitanteou sangramento maior, ocorreu em 46 pacientes (4,29 por 100 pacientes-ano) no braço de rivaroxabana em comparação com 31 pacientes (2,83 por 100 pacientes-ano) no braço de antiagregante plaquetário; a razão de risco (HR) foi 1,50 (IC 95% 0,95; 2,37).
Pacientes com síndrome antifosfolípide triplo positivo de alto risco
Em um estudo patrocinado pelo investigador multicêntrico randomizado, aberto, com o desfecho de adjudicação cego, a rivaroxabana foi comparada à varfarina em pacientes com histórico de trombose, com diagnóstico de síndrome antifosfolípide e com alto risco de eventos tromboembólicos (positivo para todos os três testes antifosfolípides: anticoagulante lúpico, anticorpos anticardiolipina e anticorpos anti-beta 2-glicoproteína I). O estudo foi encerrado prematuramente após a inclusão de 120 pacientes devido a um excesso de eventos dentre os pacientes no braço da rivaroxabana. O seguimento médio foi de 569 dias.
Cinquenta e nove pacientes foram randomizados para 20 mg de rivaroxabana (15 mg para pacientes com clearance de creatinina <50 mL / min) e 61 para varfarina (INR 2,0-3,0). Eventos tromboembólicos ocorreram em 12% dos pacientes randomizados para rivaroxabana (4 AVCs isquêmico e 3 infartos do miocárdio). Nenhum evento foi relatado em pacientes randomizados para varfarina. Sangramento importante ocorreu em 4 pacientes (7%) do grupo rivaroxabana e 2 pacientes (3%) do grupo varfarina.
Propriedades farmacocinéticas
Absorção e biodisponibilidade
A rivaroxabana é rapidamente absorvida, atingindo concentrações máximas (Cmáx) 2 a 4 horas após a ingestão do comprimido.
A absorção oral da rivaroxabana é quase completa e a biodisponibilidade oral é alta (80– 100%) para dose de 2,5 mg e 10 mg, independente das condições de jejum/alimentação. A ingestão com alimentos não afeta a AUC ou a Cmáx da rivaroxabana na dose de 10 mg. O comprimido de 10 mg de Rivaroxabana pode ser tomado com ou sem alimento.
A variabilidade da farmacocinética da rivaroxabana é moderada, com variabilidade interindividual (CV%) de 30% a 40%.
A absorção da rivaroxabana é dependente do local de liberação do princípio ativo no trato gastrintestinal. Foi relatada uma diminuição de 29% e 56% na AUC e Cmáx quando o granulado de rivaroxabana é liberado no intestino delgado proximal em comparação com o comprimido. A exposição é ainda mais reduzida quando o princípio ativo é liberado no intestino delgado distal, ou no cólon ascendente. Deve-se evitar a administração da rivaroxabana distante ao estômago que pode resultar em redução da absorção e da exposição ao princípio ativo.
A biodisponibilidade (AUC e Cmáx) foi comparável entre 20 mg de rivaroxabana administrados por via oral como comprimido triturado misturado a purê de maçã, ou suspensão em água e administrada por sonda gástrica seguido por uma refeição líquida, comparada a um comprimido inteiro. Como o perfil farmacocinético da rivaroxabana é previsível e dose-proporcional, os resultados de biodisponibilidade desse estudo são provavelmente aplicáveis para as doses mais baixas de rivaroxabana.
Exclusivo Comprimido 15mg / 20mg
Devido ao grau reduzido de absorção, uma biodisponibilidade oral de 66% foi determinada para o comprimido de 20 mg sob condições de jejum. Quando Rivaroxabana 20 mg comprimidos é tomado junto com alimentos, aumentos na AUC média ao redor de 39% foram observados quando comparados a ingestão sob condições de jejum, indicando absorção quase completa e elevada biodisponibilidade oral. Rivaroxabana 15 mg e 20 mg devem ser tomados com alimentos. Sob condições de alimentação, Rivaroxabana 10 mg, 15 mg e 20 mg comprimidos demonstraram proporcionalidade de dose.
Distribuição
A ligação às proteínas plasmáticas em humanos é alta, aproximadamente de 92% a 95%, sendo a albumina sérica o principal componente de ligação. O volume de distribuição é moderado, sendo Vss de aproximadamente 50 L.
Metabolismo e eliminação
Aproximadamente 2/3 da dose administrada de rivaroxabana, sofrem degradação metabólica, com metade sendo eliminada via renal e a outra metade, via fecal. Os demais 1/3 da dose administrada são diretamente excretados pelos rins como fármaco inalterado na urina, principalmente por secreção renal ativa.
A rivaroxabana é metabolizada por meio de CYP3A4, CYP2J2 e de mecanismos independentes do CYP. A degradação oxidativa da fração morfolinona e a hidrólise das ligações amida são os principais locais de biotransformação.
Com base em investigações in vitro, a rivaroxabana é um substrato das proteínas transportadoras gp-P (glicoproteína-P) e Bcrp (proteína de resistência ao câncer de mama).
A rivaroxabana inalterada é o composto mais importante no plasma humano, não estando presentes metabólitos maiores ou ativos circulantes. Com uma depuração sistêmica de cerca de 10 L/h, a rivaroxabana pode ser classificada como um fármaco de baixa depuração. A eliminação da rivaroxabana do plasma ocorreu com meias-vidas terminais de 5 a 9 horas em indivíduos jovens e com meias-vidas terminais de 11 a 13 horas em idosos.
Pacientes geriátricos
Pacientes idosos apresentaram concentrações plasmáticas mais altas que pacientes mais jovens, com valores médios de AUC aproximadamente 1,5 vezes maiores, devido principalmente à redução (aparente) da depuração total e renal.
Gênero
Não há diferenças clinicamente relevantes da farmacocinética entre pacientes homens e mulheres.
Peso corporal
Pesos corpóreos extremos (120 kg) tiveram apenas pequena influência nas concentrações plasmáticas de rivaroxabana (menos de 25%).
Exclusivo Comprimido 10mg
Dados agrupados obtidos dos estudos clínicos Record 1, Record 2 e Record 3 demonstraram que existe uma tendência a aumento do risco de sangramento em pacientes com peso corpóreo acima de 110 kg.
Crianças e adolescentes
A segurança e a eficácia não foram estabelecidas para crianças e adolescentes com idade inferior a 18 anos.
Diferenças étnicas
Não foram observadas diferenças clinicamente relevantes entre pacientes caucasianos, afroamericanos, hispânicos, japoneses ou chineses em relação à farmacocinética e farmacodinâmica.
Insuficiência hepática
O efeito da insuficiência hepática na farmacocinética da rivaroxabana foi estudado em indivíduos categorizados de acordo com a classificação Child Pugh, um procedimento padrão no desenvolvimento clínico. O propósito original da classificação Child Pugh é avaliar o prognóstico da doença hepática crônica, principalmente cirrose. Em pacientes nos quais o uso de anticoagulantes é pretendido, o aspecto crítico da insuficiência hepática é a redução da síntese de fatores de coagulação normais no fígado. Uma vez que este aspecto é considerado em apenas uma das cinco medições clínicas/bioquímicas que compõem o sistema de classificação Child Pugh, o risco de sangramento em pacientes pode não ser claramente correlacionado com esta classificação. A decisão de tratar os pacientes com anticoagulantes deve ser, portanto, tomada independentemente da classificação Child Pugh.
Rivaroxabana é contraindicado em pacientes com doença hepática associada à coagulopatia, levando a um risco de sangramento clinicamente relevante, incluindo pacientes cirróticos com Child Pugh B e C (15mg e 20mg).
Pacientes cirróticos com insuficiência hepática leve (classificados como Child Pugh A) apresentaram apenas pequenas alterações na farmacocinética da rivaroxabana (aumento de 1,2 vezes da AUC, em média), próximas das de seu respectivo grupo controle saudável. Nenhuma diferença relevante nas propriedades farmacodinâmicas foi observada entre estes grupos.
Em pacientes cirróticos com insuficiência hepática moderada (classificados como Child Pugh B), a média da AUC da rivaroxabana foi significativamente aumentada em 2,3 vezes comparada com voluntários sadios, devido à importante insuficiência na depuração do fármaco, o que indica uma significante doença hepática. A AUC da fração não-ligada foi aumentada em 2,6 vezes. Não há dados em pacientes com insuficiência hepática grave.
A inibição da atividade do fator Xa foi aumentada por um fator de 2,6 quando comparada a voluntários sadios; o prolongamento do TP foi similarmente aumentado por um fator de 2,1. O teste global de coagulação TP avalia a via extrínseca que compreende os fatores de coagulação VII, X, V, II e I que são sintetizados no fígado. Pacientes com insuficiência hepática moderada foram mais sensíveis à rivaroxabana, resultando em uma relação mais acentuada de Farmacocinética/Farmacodinâmica entre concentração e TP.
Não há dados disponíveis para pacientes Child Pugh C.
Insuficiência renal
Houve um aumento na exposição à rivaroxabana inversamente correlacionada com a diminuição da função renal, como avaliado pela medida da depuração de creatinina. Em indivíduos com insuficiência renal leve (ClCr ≤ 80-50 mL/min), moderada (ClCr < 50- 30 mL/min) ou grave (ClCr < 30-15 mL/min), as concentrações plasmáticas de rivaroxabana (AUC) foram 1,4; 1,5 e 1,6 vezes maiores, respectivamente, comparadas com voluntários sadios. Aumentos correspondentes nos efeitos farmacodinâmicos foram mais pronunciados.
Em indivíduos com insuficiência renal leve, moderada ou grave, a inibição total da atividade do fator Xa foi aumentada por um fator de 1,5; 1,9 e 2,0, respectivamente, quando comparada com voluntários sadios; o prolongamento do TP foi similarmente aumentado por um fator de 1,3; 2,2 e 2,4, respectivamente. Não há dados em pacientes com ClCr < 15 mL/min.
O uso não é recomendado em pacientes com depuração de creatinina < 15 mL/min. Rivaroxabana deve ser utilizado com cautela em pacientes com insuficiência renal grave (depuração de creatinina 15-30 mL/min).
Devido à doença de base, pacientes com insuficiência renal grave apresentam risco aumentado de sangramento e trombose.
Administração Concomitante de Potentes Indutores da CYP3A4
Em um estudo de fase I, a coadministração de Rivaroxabana com a rifampicina, um potente indutor da isoenzima CYP3A4 e gp-P (glicoproteína-P), levou a uma redução de aproximadamente 50% na AUC média da rivaroxabana, com reduções paralelas em seus efeitos farmacodinâmicos.
Em um estudo fase IIa, a relação PK/PD de um regime de dose adaptado de rivaroxabana adaptada (30 mg duas vezes ao dia nas primeiras três semanas de tratamento, seguidos por 20 mg duas vezes ao dia) foi estudada em 19 pacientes tratados para TVP ou EP e que, concomitantemente foram medicados com um potente indutor da isoenzima CYP3A4 e gpP (rifampicina ou fenitoína). O regime de dose adaptado nesses pacientes levou a uma exposição e farmacodinâmica similares, quando comparado a pacientes tratados para TVP (15 mg duas vezes ao dia nas primeiras três semanas de tratamento, seguido por 20 mg uma vez ao dia) sem a administração concomitante de um potente indutor da isoenzima CYP3A4.
Dados de segurança pré-clínicos
A avaliação de segurança pré-clínica em dados de estudos convencionais e apropriados de segurança farmacológica, toxicidade de dose única e de doses repetidas, genotoxicidade, fototoxicidade, carcinogenicidade e toxicidade para a reprodução não revelaram riscos especiais para humanos.
Não foi observada toxicidade órgão-específica da rivaroxabana até a mais alta dose testada.
Segurança farmacológica
As funções cardiovascular, respiratória e do SNC não foram afetadas. Não se observou potencial pró-arritmogênico.
Não foram observados efeitos clinicamente relevantes na motilidade gastrintestinal, função hepática, função renal e níveis de glicose sanguínea.
Toxicidade aguda e de doses repetidas
A rivaroxabana mostrou baixa toxicidade aguda em ratos e camundongos.
A rivaroxabana foi testada em estudos de doses repetidas por até 6 meses em ratos e por até 12 meses em cães. Com base no modo de ação farmacológico, não se pôde estabelecer NOEL (Nível de efeito não observado) em razão dos efeitos sobre o tempo de coagulação. Todos os achados adversos, exceto uma discreta redução do ganho de peso corporal em ratos e cães, puderam ser relacionados a um efeito farmacológico exagerado do composto. Em cães com exposições muito altas, foram observados sangramentos importantes espontâneos. Os NOAELs (Níveis de efeitos adversos não observados) após exposição crônica são 12,5 mg/kg em ratos e 5 mg/kg em cães.
Carcinogenicidade
A rivaroxabana foi testada até 60 mg/kg/dia, atingindo níveis de exposição semelhantes aos seres humanos (camundongo) ou até 3,6 vezes maiores (ratos) do que nos seres humanos.
A rivaroxabana não apresentou potencial carcinogênico em ratos e camundongos.
Toxicologia para a reprodução
A rivaroxabana foi testada em estudos de toxicidade para o desenvolvimento em níveis de exposição de até 14 vezes (rato) e de até 33 vezes (coelho) acima da exposição terapêutica em humanos. O perfil toxicológico se caracteriza principalmente por toxicidade materna causada por efeitos farmacodinâmicos exagerados. Até a dose mais alta testada, não se identificou potencial teratogênico primário.
A radioatividade relacionada à [C14] rivaroxabana penetrou a barreira placentária em ratos. Em nenhum dos órgãos e tecidos fetais, a exposição, em termos de concentrações máximas ou AUC, excedeu a exposição sanguínea materna. A exposição média nos fetos, baseada na AUC (0-24), alcançou cerca de 20% da exposição no sangue materno. As glândulas mamárias tinham uma AUC aproximadamente equivalente à do sangue, o que indica secreção de radioatividade no leite.
A rivaroxabana não mostrou efeito sobre a fertilidade masculina ou feminina até 200 mg/kg.
Lactação
Administrou-se [C14] rivaroxabana por via oral a ratas Wistar lactantes (dias 8 a 10 do pósparto) em dose oral única de 3 mg/kg de peso corporal.
A radioatividade relacionada à [C14] rivaroxabana foi secretada no leite das ratas lactantes apenas em uma pequena extensão em relação à dose administrada: a quantidade estimada de radioatividade excretada com o leite foi de 2,12% da dose materna no prazo de 32 horas após a administração.
Genotoxicidade
Não se observou genotoxicidade num teste para mutação genética em bactérias (Teste de Ames), um teste in vitro para aberrações cromossômicas ou no teste in vivo do micronúcleo.
Interação alimentícia: posso usar o Rivaroxabana com alimentos?
Comprimido 10mg
Rivaroxabana 10 mg pode ser administrado com ou sem alimentos.
Comprimido 15mg / 20mg
Rivaroxabana 15 mg e Rivaroxabana 20 mg devem ser administrados com alimentos.
Fontes consultadas
Bula do Profissional do Medicamento
Xarelto®.
Rixantil®.
Vynaxa®.
Cloridrato de venlafaxina

Cloridrato de Venlafaxina, para o que é indicado e para o que serve?
Cloridrato de Venlafaxina está indicado para:
Tratamento da depressão, incluindo depressão com ansiedade associada;
Prevenção de recaída e recorrência da depressão;
Tratamento de ansiedade ou transtorno de ansiedade generalizada (TAG), incluindo tratamento em longo prazo;
Tratamento do transtorno de ansiedade social (TAS), também conhecido como fobia social;
Tratamento do transtorno do pânico, com ou sem agorafobia, conforme definido no DSM-IV.
Este medicamento é contraindicado para menores de 18 anos.
Como usar o Cloridrato de Venlafaxina?
Recomenda-se a administração de Cloridrato de Venlafaxina junto com alimentos, aproximadamente no mesmo horário todos os dias.
As cápsulas devem ser tomadas inteiras com algum líquido e não devem ser divididas, trituradas, mastigadas ou dissolvidas, ou podem ser administradas cuidadosamente abrindo-se a cápsula e espalhando todo o conteúdo em uma colher de purê de maçã.
Esta mistura de medicamento/alimento deve ser engolida imediatamente sem mastigar e deve ser seguida de um copo de água para assegurar a completa deglutição dos princípios ativos.
Depressão maior
A dose inicial recomendada de Cloridrato de Venlafaxina é de 75 mg, administrada uma vez por dia (1x/dia). Os pacientes que não respondem à dose inicial de 75 mg/dia podem beneficiar-se com o aumento da dose até, no máximo, 225 mg/dia.
Transtorno de ansiedade generalizada
A dose inicial recomendada de Cloridrato de Venlafaxina é de 75 mg, administrada uma vez por dia (1x/dia). Os pacientes que não respondem à dose inicial de 75 mg/dia podem beneficiar-se com o aumento da dose até, no máximo, 225 mg/dia.
Fobia social
A dose inicial recomendada de Cloridrato de Venlafaxina é de 75 mg, administrada uma vez por dia (1x/dia). Não há evidências de que doses maiores pTranstorno do pânico
Recomenda-se que a dose de 37,5 mg/dia de Cloridrato de Venlafaxina seja usada por 7 dias. A dose deve ser aumentada para 75 mg/dia. Os pacientes que não respondem à dose inicial de 75 mg/dia podem beneficiar-se com o aumento da dose até, no máximo, 225 mg/dia.
Descontinuando o Cloridrato de Venlafaxina
Recomenda-se a redução gradativa da dose ao descontinuar o tratamento com Cloridrato de Venlafaxina. Em estudos clínicos com Cloridrato de Venlafaxina cápsulas de liberação controlada, o medicamento foi descontinuado gradativamente reduzindo-se a dose diária até 75 mg a cada semana. O período necessário para a descontinuação gradativa pode depender da dose, da duração do tratamento e de cada paciente individualmente. Em alguns pacientes, a descontinuação pode precisar ocorrer muito gradualmente durante período de meses ou maisroporcionem algum benefício adicional
Uso em pacientes com insuficiência renal
A dose diária total de Cloridrato de Venlafaxina deve ser reduzida em 25% a 50% nos pacientes com insuficiência renal com taxa de filtração glomerular (TFG) de 10 a 70 mL/min.
A dose diária total de Cloridrato de Venlafaxina deve ser reduzida em até 50% nos pacientes em hemodiálise.
Devido à variabilidade individual no clearance nesses pacientes, doses individuais podem ser aconselhadas.
Uso em pacientes com insuficiência hepática
A dose diária total de Cloridrato de Venlafaxina deve ser reduzida em até 50% em pacientes com insuficiência hepática leve a moderada. Em alguns pacientes, reduções maiores que 50% podem seEfeitos da Descontinuação
Os seguintes sintomas foram relatados em associação com a repentina interrupção ou redução de dose ou retirada de tratamento:
Hipomania, ansiedade, agitação, nervosismo, confusão, insônia ou outros distúrbios do sono, fadiga, sonolência, parestesia, tontura, convulsão, vertigem, cefaleia, sintomas de gripe, tinido, coordenação e equilíbrio prejudicados, tremor, sudorese, boca seca, anorexia, diarreia, náusea e vômito. Em estudos anteriores à comercialização, a maioria das reações à interrupção foi leve e resolvida sem tratamento. Embora estes eventos sejam geralmente autolimitados, têm havido relatos de sintomas de descontinuação graves e, por vezes, estes efeitos podem ser prolongados e graves.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
Devido à variabilidade individual no clearance, doses individuais podem ser aconselhadas.
Superdose: o que acontece se tomar uma dose do Cloridrato de Venlafaxina maior do que a recomendada?
Na experiência pós-comercialização, a superdosagem com Cloridrato de Venlafaxina ocorreu predominantemente em associação a álcool e/ou outros medicamentos. Os eventos mais frequentemente relatados em superdosagem incluem taquicardia, alterações do nível de consciência (variando de sonolência a coma), midríase, convulsão e vômitos. Outros eventos relatados incluem alterações no eletrocardiograma (por exemplo, prolongamento do intervalo QT, bloqueio de ramo, prolongamento do complexo QRS), taquicardia ventricular, bradicardia, hipotensão, vertigem e morte.
Estudos retrospectivos publicados relatam que a superdosagem com o Cloridrato de Venlafaxina pode estar associada a um aumento do risco de resultados fatais em comparação ao observado com os antidepressivos ISRS, mas inferiores aos relacionados aos antidepressivos tricíclicos. Estudos epidemiológicos demonstraram que os pacientes tratados com o Cloridrato de Venlafaxina apresentam mais fatores de risco de suicídio do que os tratados com ISRS. Não se sabe ao certo qual o grau em que a observação de risco aumentado de resultados fatais pode ser atribuída à toxicidade do Cloridrato de Venlafaxina na superdosagem em oposição a algumas características dos pacientes tratados com o Cloridrato de Venlafaxina. Para diminuir o risco de superdosagem, as prescrições de Cloridrato de Venlafaxina devem ser feitas na menor quantidade de medicamento consistente com o bom manejo do paciente.
Tratamento recomendado
Recomendam-se medidas gerais de suporte e tratamento sintomático, além de monitorização do ritmo cardíaco e dos sinais vitais. Não se recomenda a indução de vômitos quando houver risco de aspiração. Pode haver indicação para lavagem gástrica caso essa lavagem seja realizada logo após a ingestão ou em pacientes sintomáticos. A administração de carvão ativado também pode limitar a absorção do fármaco. É provável que diurese forçada, diálise, hemoperfusão e ex-sanguíneo transfusão não apresentem benefícios. Não são conhecidos antídotos específicos do Cloridrato de Venlafaxina.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
Interação medicamentosa: quais os efeitos de tomar Cloridrato de Venlafaxina com outros remédios?
Inibidores da monoaminoxidase
Foram relatadas reações adversas graves, em pacientes que interromperam recentemente o tratamento com um inibidor da monoaminoxidase (IMAO) e iniciaram o tratamento com o Cloridrato de Venlafaxina, ou que recentemente interromperam a terapia com o Cloridrato de Venlafaxina antes do início do tratamento com um IMAO.
Essas reações incluíram tremores, mioclonia, diaforese, náuseas, vômitos, rubor, tontura, hipertermia com quadro semelhante à síndrome neuroléptica maligna, convulsões e óbito.
Medicamentos ativos no Sistema Nervoso Central (SNC)
O risco do uso do Cloridrato de Venlafaxina em associação a outros medicamentos ativos no SNC ainda não foi sistematicamente avaliado. Consequentemente, recomenda-se cautela caso seja necessária a administração concomitante do Cloridrato de Venlafaxina e desses medicamentos.
Síndrome serotoninérgica
Como com outros agentes serotoninérgicos, a síndrome serotoninérgica, uma condição potencialmente de risco de vida, pode ocorrer durante o tratamento com o Cloridrato de Venlafaxina, particularmente com o uso concomitante de outros agentes que podem afetar o sistema neurotransmissor serotoninérgico como os triptanos, os ISRSs*, outros IRSNs**, o lítio, a sibutramina, fentanila e seus análogos, tramadol, dextrometorfano, tapentadol, meperidina, metadona, pentazocina ou a erva de São João (Hypericum perforatum), com medicamentos que comprometem o metabolismo da serotonina, como os IMAOs, incluindo a linezolida (um antibiótico que é um IMAO não seletivo reversível) e azul de metileno, ou com precursores da serotonina, como suplementos contendo triptofano.
Se o tratamento concomitante do Cloridrato de Venlafaxina com um ISRS*, um IRSN** ou um agonista de receptor da 5-hidroxitriptamina (triptano) for clinicamente justificado, recomenda-se observação cuidadosa do paciente, especialmente no início do tratamento e no caso de aumento da dose.
O uso concomitante do Cloridrato de Venlafaxina com precursores da serotonina, como suplementos contendo triptofano, não é recomendado.
*ISRS = inibidor seletivo da recaptação de serotonina.
**IRSN = inibidor da recaptação de serotonina e norepinefrina.
Álcool
A administração do Cloridrato de Venlafaxina não aumentou os efeitos psicomotores e psicométricos induzidos pelo etanol. No entanto, como com todos os medicamentos ativos no SNC, os pacientes devem ser aconselhados a evitar o consumo de álcool durante o uso de Cloridrato de Venlafaxina.
Um estudo farmacocinético com haloperidol mostrou uma diminuição de 42% no total do clearance oral, um aumento de 70% na AUC, um aumento de 88% no Cmáx, mas não alterou a meia-vida. Isto deve ser levado em conta em pacientes tratados com haloperidol e Cloridrato de Venlafaxina concomitantemente.
No estado de equilíbrio, a cimetidina resultou na inibição do metabolismo de primeira passagem hepática do Cloridrato de Venlafaxina; no entanto a a cimetidina não teve nenhum efeito na farmacocinética da ODV. Está previsto que a atividade global do Cloridrato de Venlafaxina mais ODV aumente apenas discretamente na maioria dos pacientes. Em idosos e em pacientes com disfunção hepática esta interação pode ser mais acentuada.
O Cloridrato de Venlafaxina não alterou a farmacocinética da imipramina e da 2-OH-imipramina. No entanto, a AUC, a Cmáx e a Cmín da desipramina aumentaram cerca de 35% na presença do Cloridrato de Venlafaxina. A AUC da 2-OH- desipramina aumentou 2,5 vezes e 4,5 vezes. A imipramina não alterou a farmacocinética do Cloridrato de Venlafaxina e da ODV. Isso deve ser considerado para pacientes tratados concomitantemente com imipramina e Cloridrato de Venlafaxina.
Um estudo farmacocinético com cetoconazol em metabolizadores extensos (ME) e metabolizadores fracos (MF) do CYP2D6 resultou em concentrações plasmáticas mais elevadas tanto de Cloridrato de Venlafaxina quanto de ODV nos indivíduos, após a administração de cetoconazol. A Cmáx do Cloridrato de Venlafaxina aumentou em 26% em indivíduos ME e 48% em indivíduos MF. Os valores de Cmáx para ODV aumentaram em 14% e 29% em indivíduos ME e MF, respectivamente. A AUC do Cloridrato de Venlafaxina aumentou em 21% em indivíduos ME e 70% em indivíduos MF. Valores de AUC para ODV aumentaram em 23% e 33% em indivíduos ME e MF, respectivamente
A administração concomitante do Cloridrato de Venlafaxina (50mg a cada 8 horas por 5 dias) e metoprolol (100mg a cada 24 horas por 5 dias) a voluntários saudáveis em um estudo de interação farmacocinética dos dois medicamentos resultou em aumento de 30- 40% das concentrações plasmáticas do metoprolol sem alterar as concentrações plasmáticas do seu metabólito ativo, o alfa- hidroximetoprolol. O Cloridrato de Venlafaxina pareceu diminuir o efeito redutor da pressão arterial do metoprolol nesse estudo em voluntários saudáveis.
A relevância clínica dessa observação em pacientes hipertensos é desconhecida. O metoprolol não alterou o perfil farmacocinético do Cloridrato de Venlafaxina nem de seu metabólito ativo, a ODV. Deve-se ter cautela com a administração concomitante do Cloridrato de Venlafaxina com o metoprolol.
O Cloridrato de Venlafaxina aumentou aproximadamente de 32% da AUC da risperidona, mas não alterou significantemente o perfil farmacocinético da porção ativa total (risperidona mais 9-hidroxirisperidona). A significância clínica desta interação não é conhecida.
O diazepam não pareceu alterar a farmacocinética do Cloridrato de Venlafaxina ou da ODV. O Cloridrato de Venlafaxina também não apresentou nenhum efeito sobre a farmacocinética e farmacodinâmica do diazepam ou de seu metabólito ativo (desmetildiazepam).
Não houve alteração da farmacocinética do estado de equilíbrio do Cloridrato de Venlafaxina e ODV coadministrada na com lítio. O Cloridrato de Venlafaxina não teve efeito sobre a farmacocinética do lítio.
Quais cuidados devo ter ao usar o Cloridrato de Venlafaxina?
Suicídio/Pensamentos suicidas ou agravamento clínico
Todos os pacientes tratados com Cloridrato de Venlafaxina devem ser apropriadamente monitorados e atentamente observados quanto à piora clínica e risco de suicídio. Os pacientes, seus familiares e cuidadores devem ser orientados a ficar alertas quanto ao aparecimento de ansiedade, agitação, ataques de pânico, insônia, irritabilidade, hostilidade, agressividade, impulsividade, acatisia (agitação psicomotora), hipomania, mania, outras alterações incomuns de comportamento, piora da depressão e ideação suicida, principalmente no início do tratamento ou durante qualquer alteração de dose ou esquema posológico.
O risco de tentativa de suicídio deve ser considerado principalmente nos pacientes com depressão. Visando reduzir o risco de superdosagem, deve-se fornecer a menor quantidade possível do medicamento, consistente com o bom manejo do paciente.
O suicídio é um risco conhecido da depressão e de outros distúrbios psiquiátricos, estes distúrbios por si só são fortes predisponentes ao risco de suicídio. As análises associadas de estudos clínicos placebo-controlados de curta duração com medicamentos antidepressivos (inibidores seletivos da receptação de serotonina [ISRSS] e outros) mostraram que estes medicamentos aumentam o risco de suicídio em crianças, adolescentes e jovens (entre 18 – 24 anos de idade) com depressão maior e outros distúrbios psiquiátricos. Estudos de curta duração não demonstraram um crescimento no risco de suicídio com antidepressivos comparado com placebo em adultos com mais de 24 anos de idade; houve uma redução no risco de suicídio com antidepressivos comparado com placebo em adultos com 65 anos ou mais.
Agressividade
Pode ocorrer agressividade em alguns pacientes que receberam antidepressivos, incluindo o tratamento com Cloridrato de Venlafaxina, redução de dose ou descontinuação. Como com outros antidepressivos, o Cloridrato de Venlafaxina deve ser usada com cautela em pacientes com histórico de agressividade.
Descontinuação
Sabe-se que os efeitos da descontinuação ocorrem com os antidepressivos e, por vezes, estes efeitos podem ser prolongados e graves. Suicídio / pensamentos suicidas e agressividade foram observados em pacientes durante mudanças no regime posológico de Cloridrato de Venlafaxina, inclusive durante a descontinuação. Recomenda-se, portanto, que a dose de Cloridrato de Venlafaxina seja reduzida gradual e individualmente e que os pacientes sejam monitorados rigorosamente durante a descontinuação. Em alguns pacientes, a descontinuação pode levar meses ou mais.
Disfunção Sexual
Os inibidores da recaptação da serotonina-noradrenalina (IRSNs) podem causar sintomas de disfunção sexual. Houve relatos de disfunção sexual de longa duração, em que os sintomas continuaram, apesar da descontinuação dos IRSNs.
Fraturas ósseas
Estudos epidemiológicos mostraram um risco aumentado de fraturas ósseas em pacientes que utilizam inibidores da recaptação da serotonina (IRS), incluindo Cloridrato de Venlafaxina. O mecanismo que leva a este risco não é inteiramente conhecido.
Uso em crianças e adolescentes
A eficácia em menores de 18 anos de idade não foi estabelecida.
Reações de Síndrome Neuroléptica Maligna (SMN)
Como com outros agentes serotoninérgicos, a síndrome serotoninérgica, uma condição potencialmente fatal, ou reações como a síndrome neuroléptica maligna (SMN), pode ocorrer com o tratamento com o Cloridrato de Venlafaxina, particularmente com o uso concomitante de outros fármacos serotoninérgicos (incluindo SSRIs, SNRIs e triptanos, fentanila, dextrometorfano, tramadol, tapentadol, meperidina, metadona e pentazocina), com medicamentos que prejudicam o metabolismo da serotonina (incluindo IMAOs, por ex.: azul de metileno), ou com antipsicóticos ou outros antagonistas da dopamina. Sintomas da síndrome serotonérgica podem incluir alterações do estado mental (ex.: agitação, alucinações e coma), instabilidade autonômica (ex.: taquicardia, oscilação da pressão arterial e hipertermia), aberrações neuromusculares (ex.: hiperreflexia, falta de coordenação) e/ou sintomas gastrointestinais (ex.: náusea, vômito e diarreia).
A síndrome serotoninérgica, em sua forma mais grave, pode assemelhar-se à SMN, que inclui hipertermia, rigidez muscular, instabilidade autonômica com possíveis flutuações rápidas dos sinais vitais e alterações do estado mental.
Se o tratamento concomitante com Cloridrato de Venlafaxina e outros agentes que possam afetar o sistema neurotransmissor serotoninérgico ou dopaminérgico for autorizado pelo médico responsável, é aconselhada observação cuidadosa do paciente, particularmente no início do tratamento ou aumento da dose.
O uso concomitante de Cloridrato de Venlafaxina com precursores da serotonina tais como suplementos contendo triptofano não é recomendado.
Glaucoma de Ângulo Fechado
Pode ocorrer midríase associada ao tratamento com o Cloridrato de Venlafaxina. Recomenda-se monitorização rigorosa dos pacientes com pressão intraocular elevada ou com risco de glaucoma agudo de ângulo estreito (glaucoma de ângulo fechado).
Sistema Cardiovascular
O Cloridrato de Venlafaxina ainda não foi avaliada em pacientes com história recente de infarto do miocárdio ou doença cardíaca instável. Portanto, deve ser utilizada com cautela nesses pacientes.
Há relatos de aumento da pressão arterial relacionado à dose em alguns pacientes tratados com o Cloridrato de Venlafaxina. Casos de pressão arterial elevada requerendo tratamento imediato foram relatados na experiência pós-comercialização. Recomenda-se a determinação da pressão arterial nos pacientes tratados com o Cloridrato de Venlafaxina.
Hipertensão preexistente deve ser controlada antes do tratamento com Cloridrato de Venlafaxina. Deve-se ter cautela em pacientes com condições subjacentes que possam ser comprometidas por aumentos da pressão arterial.
Pode ocorrer aumento da frequência cardíaca, particularmente nas doses mais altas. Deve-se ter cautela em pacientes em condições subjacentes que podem ser comprometidas pelo aumento da frequência cardíaca.
Casos de prolongamento do intervalo QTc, Torsade de Pointes (TdP), taquicardia ventricular e morte súbita foram relatados durante o uso pós-comercialização do Cloridrato de Venlafaxina. A maioria dos relatos ocorreu em associação com superdosagem ou em pacientes com outros fatores de risco para prolongamento do intervalo QTc/Torsade de Pointes. Portanto, o Cloridrato de Venlafaxina deve ser usada com precaução em pacientes com fatores de risco para prolongamento do intervalo QTc.
Convulsões
Podem ocorrer convulsões com o tratamento com o Cloridrato de Venlafaxina. Assim como ocorre com todos os antidepressivos, o tratamento com o Cloridrato de Venlafaxina deve ser introduzido com cautela em pacientes com história de convulsões.
Mania/Hipomania
Pode ocorrer mania/hipomania em uma pequena parcela de pacientes com distúrbios de humor que receberam antidepressivos, incluindo o Cloridrato de Venlafaxina. Assim como ocorre com outros antidepressivos, o Cloridrato de Venlafaxina deve ser usada com cautela em pacientes com história pessoal ou familiar de transtorno bipolar.
Hiponatremia
Casos de hiponatremia e/ou síndrome da secreção inapropriada do hormônio antidiurético (SIADH) podem ocorrer com a venlafaxina, usualmente em pacientes com depleção de volume ou desidratados. Pacientes idosos, pacientes fazendo uso de diuréticos e pacientes com depleção de volume, podem ter risco aumentado para esse evento.
Sangramento
Medicamentos que inibem a recaptação de serotonina podem ocasionar anormalidades na agregação plaquetária. Existem relatos de anormalidades de sangramento com o Cloridrato de Venlafaxina, desde sangramento cutâneo e das membranas mucosas e hemorragia gastrointestinal, inclusive com risco de morte.
Como ocorre com outros inibidores da recaptação da serotonina (IRSs), deve-se ter cuidado ao administrar o Cloridrato de Venlafaxina em pacientes predispostos a sangramentos, incluindo pacientes que fazem uso de anticoagulantes e inibidores plaquetários.
Redução de peso
A segurança e a eficácia da terapia com o Cloridrato de Venlafaxina em associação a agentes redutores de peso, incluindo a fentermina, ainda não foram estabelecidas. Não se recomenda a administração concomitante do cloridrato de Cloridrato de Venlafaxina com agentes redutores de peso. O cloridrato de Cloridrato de Venlafaxina não é indicado para redução de peso nem em monoterapia nem em associação com outros produtos.
Colesterol sérico
Observou-se aumento, clinicamente relevante, do colesterol sérico em 5,3% dos pacientes tratados com o Cloridrato de Venlafaxina e 0,0% nos pacientes que receberam placebo, por no mínimo 3 meses, em estudos clínicos controlados por placebo. A determinação dos níveis de colesterol sérico deve ser considerada durante o tratamento em longo prazo.
Abuso e dependência
Estudos clínicos não evidenciaram comportamento de busca por drogas (lícitas e ilícitas), desenvolvimento de tolerância ou elevação indevida de dose do Cloridrato de Venlafaxina durante o período de uso.
Estudos in vitro revelaram que o Cloridrato de Venlafaxina praticamente não tem afinidade com opiáceos, benzodiazepínicos, a fenciclidina (PCP) ou receptores de ácido N-metil-D-aspártico (NMDA). Não foi demonstrado que o Cloridrato de Venlafaxina apresenta qualquer atividade estimulante do sistema nervoso central (SNC) significativa em roedores.
Em estudos de discriminação do medicamento com primatas, o Cloridrato de Venlafaxina não mostrou nenhum risco significativo de abuso por efeitos estimulantes ou depressores.
Em um estudo de autoadministração, macacos rhesus autoadministraram o Cloridrato de Venlafaxina intravenosamente.
Gravidez
A segurança do Cloridrato de Venlafaxina durante a gravidez em humanos ainda não foi estabelecida. O Cloridrato de Venlafaxina deve ser administrada a mulheres grávidas apenas se os benefícios esperados superarem os riscos possíveis. Se o Cloridrato de Venlafaxina for usada até o nascimento ou um pouco antes do nascimento, os efeitos da descontinuação no recém-nascido devem ser considerados.
Alguns neonatos expostos ao Cloridrato de Venlafaxina no final do terceiro trimestre da gestação desenvolveram complicações que requereram alimentação enteral, suporte respiratório ou hospitalização prolongada. Essas complicações podem surgir imediatamente após o parto.
Quando o Cloridrato de Venlafaxina foi administrada por via oral em ratas prenhas ao longo de toda a gestação e lactação, houve diminuição no peso dos filhotes, aumento no número de natimortos e aumento no número de mortes das crias durante os primeiros 5 dias da lactação, quando a administração da dosagem foi iniciada durante a gravidez e continuou até o desmame. A causa da morte não é conhecida.
Estes efeitos ocorreram com doses 10 vezes (numa base mg/kg) ou 2,5 vezes (numa base mg/m2) a dose diária humana de 375 mg de Cloridrato de Venlafaxina. A dose sem efeito sobre a mortalidade da prole de ratos foi 1,4 vezes a dose humana, em uma base mg/kg, ou 0,25 vezes a dose humana, em uma base mg/m2.
Um estudo longitudinal prospectivo de 201 mulheres com história de depressão maior que eram eutímicas no início da gravidez mostrou que as mulheres que interromperam a medicação antidepressiva durante a gravidez tinham maior probabilidade de apresentar uma recidiva da depressão maior do que as mulheres que continuaram a medicação antidepressiva.
A exposição a IRSNs do meio ao final da gravidez pode aumentar o risco de pré-eclâmpsia, e a exposição a IRSNs perto do parto pode aumentar o risco de hemorragia pós-parto.
Cloridrato de Venlafaxina é um medicamento classificado na categoria C de risco de gravidez. Portanto, este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Lactação
O Cloridrato de Venlafaxina e a ODV são excretadas no leite materno; portanto, deve-se decidir entre não amamentar ou descontinuar o uso de Cloridrato de Venlafaxina.
Uso em idosos
Não há recomendação específica para ajuste de dose do Cloridrato de Venlafaxina de acordo com a idade do paciente.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
Em voluntários saudáveis, o Cloridrato de Venlafaxina não alterou o desempenho psicomotor, cognitivo ou comportamental complexo. No entanto, qualquer psicofármaco pode comprometer o julgamento, o raciocínio e a capacidade motora. Portanto, os pacientes devem ser alertados quanto aos efeitos sobre a capacidade de dirigir veículos e operar máquinas perigosas.
Durante o tratamento, o paciente não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas.
As cápsulas de Cloridrato de Venlafaxina contêm esferas que são liberam lentamente o medicamento no trato digestivo. A porção insolúvel destas esferas é eliminada e pode ser vista nas fezes.
Atenção: Este medicamento contém corantes que podem, eventualmente, causar reações alérgicas.
Características Farmacológicas
Propriedades farmacodinâmicas
O Cloridrato de Venlafaxina e a O-desmetilCloridrato de Venlafaxina (ODV), seu metabólito ativo, são inibidores potentes da recaptação neuronal de serotonina e norepinefrina e inibidores fracos da recaptação da dopamina. Acredita-se que a atividade antidepressiva do Cloridrato de Venlafaxina esteja relacionada à potencialização da atividade neurotransmissora no Sistema Nervoso Central (SNC). O Cloridrato de Venlafaxina e a ODV não têm afinidade significante in vitro por receptores muscarínicos, histaminérgicos ou α1-adrenérgicos. A atividade nesses receptores está potencialmente relacionada com vários efeitos anticolinérgicos, sedativos e cardiovasculares observados com outros medicamentos psicotrópicos.
Em modelos pré-clínicos com roedores, o Cloridrato de Venlafaxina demonstrou atividade preditiva de ações ansiolíticas e antidepressivas e propriedades de aprimoramento cognitivo.
Eletrofisiologia cardíaca
Em um estudo QTc completo e dedicado em indivíduos saudáveis, a venlafaxina não prolongou o intervalo QT em qualquer extensão clinicamente relevante a uma dose de 450 mg/dia (na forma de 225 mg administrada duas vezes ao dia).
Propriedades farmacocinéticas
Absorção
Após a administração de Cloridrato de Venlafaxina cápsulas de liberação controlada, as concentrações plasmáticas máximas de Cloridrato de Venlafaxina e ODV foram alcançadas em 5,5 e 9 horas, respectivamente.
Distribuição
As concentrações plasmáticas no estado de equilíbrio do Cloridrato de Venlafaxina e da ODV são atingidas em 3 dias de tratamento em dose múltipla com Cloridrato de Venlafaxina de liberação imediata. Ambas apresentam cinética linear no intervalo de dose de 75 a 450mg/dia após administração a cada 8 horas. As respectivas taxas de ligação às proteínas plasmáticas humanas do Cloridrato de Venlafaxina e da ODV são de aproximadamente 27% e 30%.
Como essa ligação não depende das respectivas concentrações do fármaco até 2.215 e 500 ng/mL, tanto o Cloridrato de Venlafaxina como a ODV apresentam baixo potencial de interações medicamentosas significantes que envolvem deslocamento do fármaco das proteínas séricas. O volume de distribuição do Cloridrato de Venlafaxina no estado de equilíbrio é de 4,4 + 1,9 L/kg após a administração intravenosa.
Metabolismo
O Cloridrato de Venlafaxina sofre extenso metabolismo hepático. Estudos in vitro e in vivo indicam que o Cloridrato de Venlafaxina é biotransformada no seu principal metabólito ativo, a ODV, pela isoenzima CYP2D6 do P450. Estudos in vitro e in vivo indicam que o Cloridrato de Venlafaxina é metabolizada em um metabólito secundário, menos ativo, a N-desmetilCloridrato de Venlafaxina, pela CYP3A4.
Embora a atividade relativa da CYP2D6 possa ser diferente entre os pacientes, não há necessidade de modificação do esquema posológico do Cloridrato de Venlafaxina. A exposição ao fármaco (AUC) e a variação nos níveis plasmáticos do Cloridrato de Venlafaxina e da ODV foram equivalentes após a administração de doses diárias iguais em esquemas duas vezes ao dia ou três vezes ao dia de Cloridrato de Venlafaxina de liberação imediata.
Eliminação
O Cloridrato de Venlafaxina e seus metabólitos são excretados principalmente pelos rins. Aproximadamente 87% da dose de Cloridrato de Venlafaxina é recuperada na urina em até 48 horas tanto como Cloridrato de Venlafaxina inalterada (5%), ODV não conjugada (29%), ODV conjugada (26%) ou outros metabólitos secundários inativos (27%).
Efeito dos alimentos
Os alimentos não exercem efeito significante sobre a absorção do Cloridrato de Venlafaxina ou a formação da ODV.
Pacientes com insuficiência hepática
Ocorre alteração significante da disposição farmacocinética do Cloridrato de Venlafaxina e da ODV em alguns pacientes com cirrose hepática compensada (dano hepático moderado) após dose única oral de Cloridrato de Venlafaxina. Em pacientes com insuficiência hepática, os valores da depuração plasmática média do Cloridrato de Venlafaxina e da ODV diminuem em aproximadamente 30% a 33%, e de meia-vida média de eliminação aumentam 2 vezes ou mais em comparação aos indivíduos normais.
Em um segundo estudo, o Cloridrato de Venlafaxina foi administrada por via oral e por via intravenosa em indivíduos normais (n = 21) e indivíduos Child-Pugh A (n = 8) e Child-Pugh B (n = 11), insuficiência hepática leve e moderada, respectivamente. A biodisponibilidade por via oral aproximadamente dobrou em pacientes com insuficiência hepática em comparação aos indivíduos normais. Nos pacientes com insuficiência hepática, a meia-vida de eliminação do Cloridrato de Venlafaxina oral foi aproximadamente duas vezes maior e o clearance por via oral foi reduzido em mais da metade em comparação aos indivíduos normais.
Em pacientes com insuficiência hepática a meia-vida de eliminação da ODV oral foi prolongada em cerca de 40% ao passo que o clearance da ODV foi semelhante ao de indivíduos normais. Observou-se um grau elevado de variabilidade interindividual.
Pacientes com insuficiência renal
As meias-vidas de eliminação do Cloridrato de Venlafaxina e da ODV aumentaram com o grau de comprometimento da função renal. A meia-vida de eliminação aumentou em aproximadamente 1,5 vezes em pacientes com insuficiência renal moderada e por aproximadamente 2,5 e 3 vezes em pacientes com doença renal em estágio terminal.
Estudos em idade e sexo
Uma análise de farmacocinética populacional com 404 pacientes tratados com Cloridrato de Venlafaxina de liberação imediata em dois estudos com esquemas de administração de duas vezes ao dia e três vezes ao dia demonstrou que os níveis plasmáticos mínimos de Cloridrato de Venlafaxina ou ODV, normalizados pela dose, não foram alterados por diferenças de idade ou sexo.
Dados pré-clínicos de segurança
Carcinogênese
O Cloridrato de Venlafaxina foi administrada por gavagem a camundongos por 18 meses em doses de até 120mg/kg por dia, 1,7 vezes a dose humana máxima recomendada em uma relaçãomg/m2. O Cloridrato de Venlafaxina também foi administrada a ratos por gavagem por 24 meses em doses de até 120mg/kg por dia.
Em ratos que receberam a dose de 120mg/kg, as concentrações plasmáticas de Cloridrato de Venlafaxina na necropsia eram 6 vezes (ratos fêmeas) e 1 vez (rato macho) e as concentrações plasmáticas de pacientes que receberam a dose humana máxima recomendada. Os níveis plasmáticos de ODV foram inferiores em ratos quando comparados aos pacientes que receberam a dose máxima recomendada.
Tumores não foram aumentados pelo tratamento com Cloridrato de Venlafaxina em camundongos ou ratos.
Mutagenicidade
O Cloridrato de Venlafaxina e ODV não foram mutagênicas no teste de Ames de mutação reversa com a bactéria Salmonella ou teste de ovário de hamster chinês/hipoxantina guanina fosforibosil transferase (HGPRT) de mutação genética de célula de mamíferos. O Cloridrato de Venlafaxina também não foi mutagênica ou clastogênica no ensaio in vitro BALB/c-3T3 de transformação de célula de camundongo, no teste de troca entre cromátides irmãs em cultura de células de ovários de hamster chinês, ou teste in vivo de aberração cromossômica em medula óssea de ratos. A ODV não foi clastogênica no ensaio in vitro de aberração cromossômica em células de ovários de hamster chinês, ou em ensaio in vivo de aberração cromossômica em medula óssea de ratos.
Prejuízo à fertilidade
Os estudos de reprodução e fertilidade em ratos não mostraram nenhum efeito sobre a fertilidade masculina ou feminina em doses orais de até 8 vezes a dose humana máxima recomendada diariamente, em uma base demg/kg, ou de até 2 vezes numa base de mg/m2.
Observou-se redução da fertilidade em um estudo em que ratos machos e fêmeas foram expostos ao principal metabólito de Cloridrato de Venlafaxina (ODV). Esta exposição a ODV foi aproximadamente 2 a 3 vezes a da dose humana de 225mg/dia de Cloridrato de Venlafaxina. A relevância desta descoberta sobre humanos é desconhecida.
Teratogenicidade
O Cloridrato de Venlafaxina não causou malformações na prole de ratos ou coelhos quando administrada em doses até 11 vezes (ratos) ou 12 vezes (coelhos) a dose humana de 375mg/dia de Cloridrato de Venlafaxina em uma base demg/kg, ou 2,5 vezes (ratos) e 4 vezes (coelhos) a dose humana de 375mg/dia de Cloridrato de Venlafaxina, em uma relaçãomg/m2
Referências Bibliográficas:
1 Feighner J, Entsuah A, McPherson M. Efficacy of once-daily venlafaxine extended release (XR) for symptoms of anxiety in depressed outpatients. J Affect Disord. 1998;47:55-62.
2 Cunningham LA, for the Venlafaxine XR 208 Study Group. Once-daily venlafaxine extended release (XR) and venlafaxine immediate release (IR) in outpatients with major depression. Ann Clin Psychiatry. 1997;9(3):157-64.
3 Thase ME, for the Venlafaxine XR 209 Study Group. Efficacy and tolerability of once-daily venlafaxine extended-release (XR) in outpatients with major depression. J Clin Psychiatry. 1997;58(9):393-8.
4 Hamilton MA. A rating scale for depression. J Neurol Neurosurg Psychiatry 1960;23:56-62.
5 Montgomery SA, Asberg M. A new depression scale designed to be sensitive to change. Br J Psychiatry. 1979;134:382-9.
6 Guy W. ECDEU Assessment Manual for Psychopharmacology, Revised. DHEW Pub. No. (ADM) 76-338. Rockville, MD: National Institutes of Mental Health, 1976;217-222.
7 Derivan A, Haskins T, Rudolph R, Pallay A, Aguiar L, for the Venlafaxine XR 210 Study Group. Double-blind, placebo-controlled study of once daily venlafaxine XR in outpatients with generalized anxiety disorder (GAD). Proceedings of the American Psychiatric Association Annual Meeting; June 1998;Toronto,Ontario.
8 Davidson J, DuPont R, Hedges D, Haskins T. Efficacy, safety, and tolerability of venlafaxine extended release and buspirone in outpatients with generalized anxiety disorder. J Clin Psychiatry 1999;60:528-535.
9 Jokela H, Karkkainen J, Pekkarinen H, et al. A double-blind, placebo-controlled, parallel-group, dose-ranging study of venlafaxine extended-release capsules in outpatients with general anxiety disorder: final report (Protocol 0600B2-378-EU). Wyeth-Ayerst Laboratories GMR-31786, 1997.
10 Hackett D, Parks V, Salinas E, for the Venlafaxine XR 378 Study Group. A 6-month evaluation of 3 dose levels of venlafaxine extended-release in non-depressed outpatients with generalized anxiety disorder. Proceeding from the Annual Meeting of the Anxiety Disorders Association of America; March 26, 1999; San Diego, CA.
11 Cunningham LA, for the Venlafaxine XR 208 Study Group. Once-daily venlafaxine extended release (XR) and venlafaxine immediate release (IR) in outpatients with major depression. Ann Clin Psychiatry 1997;9(3):157-64.
12 Haskins JT, Rudolph R, Aguiar L, Entsuah R, Salinas E, for the Venlafaxine XR 218 Study Group. Venlafaxine XR is an efficacious short- and long-term treatment for generalized anxiety disorder. Proceedings from the Annual Meeting of the Anxiety Disorders Association of America; March 26, 1999; San Diego, CA
